题目内容
【题目】实验室欲配制480 mL 0.5 mol·L-1的NaOH溶液,请按要求完成下列内容:
(1)完成本实验时,下列仪器中一定不需要的是________(填字母,下同)。

(2)通过计算可知,需天平称量NaOH固体的质量为______g。
(3)配制过程一般可分为以下几个步骤:①称量、②计算、③溶解、④摇匀、⑤转移、⑥洗涤、⑦定
容、⑧振荡、⑨装瓶贴签,正确的操作顺序为_____(填序号)。小明认为还缺少一个步骤,此步骤的名称是______。
(4)实验结束后,发现所配溶液浓度偏大,可能的原因是________(填代号)。
A. 所用NaOH已潮解 B. 定容时俯视观察液面
C. 未洗涤烧杯 D. 称量时砝码与NaOH的位置颠倒
【答案】D 10.0 ②①③⑤⑥⑧⑦④⑨ 冷却 B
【解析】
(1)分液漏斗是可用于固液或液体与液体反应的发生装置和对萃取后形成的互不相溶的液体进行分液的玻璃仪器,据此分析;
(2)根据m=M![]() n=M
n=M![]() c
c![]() v计算需NaOH固体的质量;
v计算需NaOH固体的质量;
(3)根据氢氧化钠溶于水放热分析;
(4)所配溶液浓度偏大,则称量氢氧化钠的质量偏大或溶液体积偏小,据此分析可能的原因。
(1)配制480 mL 0.5 mol·L-1的NaOH溶液,一定不需要的是分液漏斗,故答案为:D;
(2)配制480 mL 0.5 mol·L-1的NaOH溶液,需要使用500mL容量瓶,计算时应用500mL进行计算,需NaOH的质量为:m=M![]() n=M
n=M![]() c
c![]() v=40g/mol
v=40g/mol![]() 0.5mol/L
0.5mol/L![]() 0.5L=10.0g,故答案为:10.0g;
0.5L=10.0g,故答案为:10.0g;
(3)配制过程的正确操作顺序为:②计算、①称量、③溶解、⑤转移、⑥洗涤、⑧振荡、⑦定容、④摇匀、⑨装瓶贴签;由于氢氧化钠溶于水放热,需要冷却至室温才能转移至容量瓶中,故还缺少的一个步骤为冷却,故答案为:②①③⑤⑥⑧⑦④⑨;冷却;
(4)A.所用NaOH已潮解,则固体NaOH的质量偏低,所配制的溶液浓度偏小,故不选;
B.定容时俯视观察液面,则定容时溶液体积偏小,所配制的溶液浓度偏大,故选;
C.未洗涤烧杯会使部分溶质损失,所配制的溶液浓度偏小,故不选;
D.称量时砝码与NaOH的位置颠倒,因本实验称量氢氧化钠的质量为10.0g,未用到游码,所以该错误操作对本实验结果无影响,故不选;故答案为:B。

 名校课堂系列答案
名校课堂系列答案【题目】二烯烃与溴反应制备多卤代物,反应的区域选择性在有机合成中具有重要意义。1,3–丁二烯(g) (CH2=CH—CH=CH2)和Br2(g)反应原理如下:
①CH2=CH-CH=CH2(g)+Br2(g)→![]() (g) △H1=akJ·mol-1
(g) △H1=akJ·mol-1
②CH2=CH-CH=CH2(g)+Br2(g)→ (g) △H2=bkJ·mol-1
(g) △H2=bkJ·mol-1
③![]() (g)
(g) (g) △H3
(g) △H3
回答下列问题:
(1)△H3=_____________。
(2)1,3-丁二烯和Br2反应的能量随反应过程的变化关系如图所示:

1,3-丁二烯和Br2反应会生成两种产物,一种称为动力学产物,由速率更快的反应生成;一种称为热力学产物,由产物更加稳定的反应生成。则动力学产物结构简式为_________
(3)T℃时在2L刚性密闭容器中充入1,3-丁二烯(g)(CH2=CH-CH=CH2)和Br2(g)各2mol,发生反应。1,3-丁二烯及产物的物质的量分数随时间的变化如下表:
时间(min) | 0 | 10 | 20 | 30 | 40 |
1,3-丁二烯 | 100% | 72% | 0% | 0% | 0% |
1,2加成产物 | 0% | 26% | 10% | 4% | 4% |
1,4加成产物 | 0% | 2% | 90% | 96% | 96% |
在0 ~20min内,反应体系中1,4-加成产物的平均反应速率v(1,4加成产物)=_______。
(4)对于反应③,若要提高1,4-加成产物 ( )平衡体系中的物质量分数,可以采取的措施有_____
)平衡体系中的物质量分数,可以采取的措施有_____
A.适当升高温度 B.使用合适的催化剂
C.增大体系的压强 D.将1,4加成产物及时从体系分离
(5)反应 1,3-丁二烯二聚体的解聚为可逆反应:
 (g)
(g)![]() 2
2![]() (g) △H>0
(g) △H>0
在一定条件下,C4H6和C8H12的消耗速率与各自分压有如下关系:v(C8H12)=k1·p(C8H12),v(C4H6)=k2·p2(C4H6)。相应的速率与其分压关系如图所示,一定温度下k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=_____;在图中标出点(A、B、C、D)中,能表示反应达到平衡状态的点是______ ,理由是________。

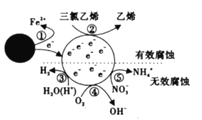
【题目】某小组研究了铜片与![]() 反应的速率,实现现象记录如下表。
反应的速率,实现现象记录如下表。
实验 | 时间段 | 现象 |
|
| 铜片表面出现极少气泡 |
| 铜片表面产生较多气泡,溶液呈很浅的蓝色 | |
| 铜片表面均匀冒出大量气泡 | |
| 铜片表面产生较少气泡,溶液蓝色明显变深,液面上方呈浅棕色 |
为探究影响该反应速率的主要因素,小组进行如下实验。
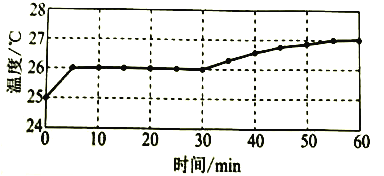
实验I:监测上述反应过程中溶液温度的变化,所得曲线如下图。
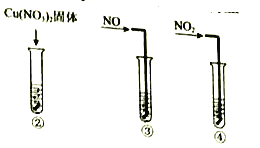
实验II:②-④试管中加入大小、形状相同的铜片和相同体积、 ![]() 。结果显示:
。结果显示:![]() 对
对![]() 和
和![]() 反应速率的影响均不明显,
反应速率的影响均不明显,![]() 能明显加快该反应的速率。
能明显加快该反应的速率。
实验III:在试管中加入铜片和![]() ,当产生气泡较快时,取少量反应液于试管中,检验后发现其中含有
,当产生气泡较快时,取少量反应液于试管中,检验后发现其中含有![]() 。
。
(1)根据表格中的现象,描述该反应的速率随时间的变化情况:____________。
(2)实验![]() 的结论:温度升高___________(填“是”或“不是”)反应速率加快的主要原因。
的结论:温度升高___________(填“是”或“不是”)反应速率加快的主要原因。
(3)实验II的目的是:__________
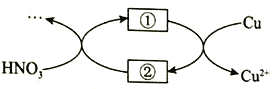
(4)小组同学查阅资料后推测:该反应由于生成某中间产物而加快了反应速率。请结合实验II、III,在下图方框内填入相应的微粒符号①____②_____,以补全催化机理。
(5)为验证(4)中猜想,还需补充一个实验:__________(请写出操作和现象)。