题目内容
【题目】化合物A是一种危险化学制品,具有腐蚀性、可自燃性。主要用于医药工业,在有机合成中用作催化剂等。其结构如图所示,其中W、X、Y、Z是处于三个不同短周期且原子序数依次递增的常见元素,X、Y核外电子层数相同,Y核外最外层电子数是X内层电子数的3倍。下列叙述正确的是( )
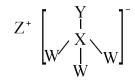
A.原子半径:Y>X>Z>W
B.简单气态氢化物的稳定性:X>Y
C.X与W形成的常见化合物有两种
D.W和Z形成的化合物为离子化合物
【答案】D
【解析】
W、X、Y、Z是处于三个不同短周期且原子序数依次递增的常见元素,根据 可知,Z可形成+1价阳离子,为第ⅠA族元素,W能形成一个共价键,X能形成4个共价键,则Z为Na元素,W为H元素,X为C元素,X、Y核外电子层数相同,Y核外最外层电子数是X内层电子数的3倍,Y为O元素,A的分子式为CH3ONa,据此分析解答。
可知,Z可形成+1价阳离子,为第ⅠA族元素,W能形成一个共价键,X能形成4个共价键,则Z为Na元素,W为H元素,X为C元素,X、Y核外电子层数相同,Y核外最外层电子数是X内层电子数的3倍,Y为O元素,A的分子式为CH3ONa,据此分析解答。
根据分析,W为H元素,X为C元素,Y为O元素,Z为Na元素,A的分子式为CH3ONa;
A.同周期元素,随核电荷数增大,半径减小,H元素为元素周期表中原子半径最小的元素,Na元素为短周期中原子半径最大的元素,则原子半径:Z>X>Y>W,故A错误;
B.X为C元素,Y为O元素,非金属性越强,简单气态氢化物的稳定性越强,非金属性:X<Y简单气态氢化物的稳定性:X<Y,故B错误;
C.W为H元素,X为C元素,X与W形成的化合物有多种只含碳氢两种元素的烃类有机化合物,如甲烷、乙烯、乙炔、乙烷、丙烷等等都为常见化合物,故C错误;
D.W为H元素,Z为Na元素,W和Z形成的化合物为NaH,属于离子化合物,故D正确;
答案选D。

【题目】钛、镍、铅单质及其化合物在工业生产中有广泛的应用。回答下列问题:
(1)Ti3+的价电子排布式为____,Ti3+的还原性常用于钛含量的测定。将某含钛试样溶解于强酸溶液中生成TiO2+,加入铝片将TiO2+转化为Ti3+,该反应的离子方程式为_____,然后以NH4SCN溶液作指示剂,用FeCl3标准溶液滴定。可见,Fe3+先与____反应(填“Ti3+”或“SCN-”)。
(2)已知:
物质 | 性 质 |
TiC | 质硬,熔点:3140℃,沸点:4820℃ |
TiCl4 | 熔点:-25℃,沸点:136.4℃,具有挥发性 |
TiC的熔沸点明显高于TiCl4的原因为______________。
(3)乙二胺四乙酸(俗名EDTA)结构如图,

是代表性的螯合剂,分子中可作为配位原子的是________(填元素符号,下同),第一电离能最大的元素是_________。EDTA可与Ni2+、Ca2+、Pb2+等离子形成配合物,可用Na2[Ca(EDTA)] 治疗铅中毒,其离子方程式为_______________。
(4)图甲是LaNi5晶体示意图,该结构由两种不同的原子层组成,第一层![]() 填入由
填入由![]() 组成的正三角形空穴中心,第二层完全由
组成的正三角形空穴中心,第二层完全由![]() 组成,具有平面六方对称性,原子数目等于第一层的
组成,具有平面六方对称性,原子数目等于第一层的![]() 和
和![]() 数目的总和,这两层交替排列形成LaNi5晶体。图乙是LaNi5的六方晶胞,图乙中
数目的总和,这两层交替排列形成LaNi5晶体。图乙是LaNi5的六方晶胞,图乙中![]() 代表____(填“La”或“Ni”)原子。该LaNi5晶体的密度为_______gcm-3(列出计算式。NA为阿伏加德罗常数的值,LaNi5摩尔质量为M gmol-1)。图乙晶胞中原子坐标参数A为(0,0,0),B为(
代表____(填“La”或“Ni”)原子。该LaNi5晶体的密度为_______gcm-3(列出计算式。NA为阿伏加德罗常数的值,LaNi5摩尔质量为M gmol-1)。图乙晶胞中原子坐标参数A为(0,0,0),B为(![]() ,
,![]() ,
,![]() ),则C点的原子坐标参数为__________。
),则C点的原子坐标参数为__________。