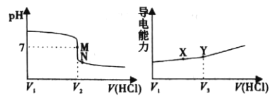
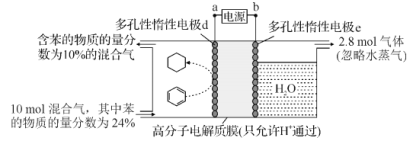
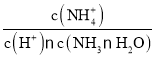题目内容
【题目】铼(Re)是种银白色的重金属,是地球地壳中最稀有的元素之一,它广泛应用于航空航天领域。在工业上,高温灼烧含ReS2的矿粉,可以制备Re2O7。另一种途径是从炼铜的废液中提取铼,其简易工艺流程如图(部分副产物省略,铼在废液中以ReO4-形式存在)。下列说法错误的是( )
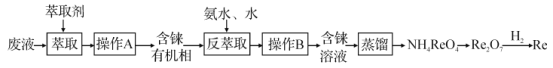
A.在“反萃取”中,加入氨水、水的目的是萃取有机层中的ReO4-
B.在NH4ReO4制备Re2O7的过程中,产生的副产物可回收利用
C.实验室在H2还原Re2O7的过程中,一共消耗7 mol H2,则可制得2 mol Re
D.以含ReS2的矿石原料生产48.4 t Re2O7,理论上转移电子3.0×106 mol
【答案】C
【解析】
A.在“反萃取”中,加入氨水、水可反应产生NH4ReO4,以达到萃取有机层中的ReO4-,A正确;
B.NH4ReO4不稳定,受热分解产生Re2O7,反应方程式为:NH4ReO4 ![]() Re2O7+2NH3↑+H2O,反应产生的副产物NH3可用于反萃取,提取有机物中的ReO4-,因而可以达到回收利用的目的,B正确;
Re2O7+2NH3↑+H2O,反应产生的副产物NH3可用于反萃取,提取有机物中的ReO4-,因而可以达到回收利用的目的,B正确;
C.实验室在H2还原Re2O7的过程中,H2除作还原剂外,还作保护气,在实验前要先通入H2排除装置中的空气,反应结束后要进一步通入H2,使制取得到的Re在H2的还原性环境中冷却,防止Re被热的空气氧化,因此若共消耗7 mol H2,则制得Re 是物质的量小于 2 mol,C错误;
D.工业上,高温灼烧含ReS2的矿粉,可以制备Re2O7,涉及反应为4ReS2+15O2![]() 2Re2O7+8SO2,则生成1 mol Re2O7,转移30 mol电子,48.4 t Re2O7的物质的量为n(Re2O7)=
2Re2O7+8SO2,则生成1 mol Re2O7,转移30 mol电子,48.4 t Re2O7的物质的量为n(Re2O7)=![]() mol=1.0×105 mol,则反应转移电子的物质的量n(e-)=1.0×105 mol×30=3.0×106 mol,D正确;
mol=1.0×105 mol,则反应转移电子的物质的量n(e-)=1.0×105 mol×30=3.0×106 mol,D正确;
故合理选项是C。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案