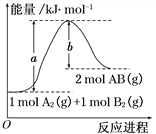
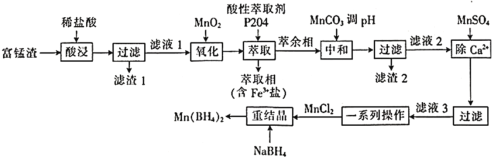
【题目】硼氢化锰![]() 可以用作储氢材料,也能用于科学研究。以富锰渣(含60% MnO,还含有SiO2、Al2O3、CaO、FeO)为原料制备硼氢化锰的工艺流程如下。
可以用作储氢材料,也能用于科学研究。以富锰渣(含60% MnO,还含有SiO2、Al2O3、CaO、FeO)为原料制备硼氢化锰的工艺流程如下。
已知几种氢氧化物的Ksp 的值如下表:
氢氧化物 |
|
|
|
|
Ksp |
|
|
|
|
请回答下列问题:
(1) NaBH4中B的化合价为________价。
(2)下列物质中与滤渣1不发生反应(高温或常温下)的是________(填字母)。
A.浓硝酸 B.氢氧化钠溶液 C.碳酸钠 D.氢氟酸
(3)“氧化”中发生反应的离子方程式为________________,该反应中氧化性:![]() ________(填“
________(填“![]() ”或“
”或“![]() ”) MnO2。
”) MnO2。
(4)“中和”时,调节pH约为________。(当溶液中的离子浓度小于![]() 时,沉淀达到完全,结果保留2位有效数字)
时,沉淀达到完全,结果保留2位有效数字)
(5) Mn(BH4)2能与稀盐酸反应生成H3BO3,该反应的化学方程式为________________。
(6)测定富锰渣中铁的含量:取20g富锰渣,经过上述“酸浸”“过滤”“氧化”“萃取”后,将萃取相(假设Fe3+span>全部被萃取)转入烧杯中,加入足量稀硫酸,充分反应后静置、分液,再向含Fe3+的溶液中加入足量KI,充分反应后,将溶液配制成500mL,取25mL于锥形瓶中并加入淀粉指示剂,最后用![]() 的Na2S2O3标准液滴定,进行三次平行实验,测得消耗Na2S2O3标准液的体积如表所示。
的Na2S2O3标准液滴定,进行三次平行实验,测得消耗Na2S2O3标准液的体积如表所示。
实验次数 | 1 | 2 | 3 |
Na2S2O3标准液体积/ | 23.20 | 24.80 | 25.20 |
已知:I2+2Na2S2O3==2NaI+Na2S4O6
①滴定达到终点时溶液的颜色变化为________。
②富锰渣中铁的含量为________。