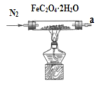
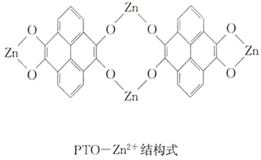
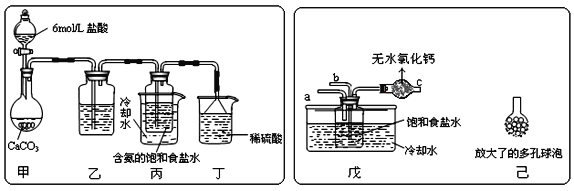
题目内容
【题目】化学反应A2(g) + B2(g)=2AB(g) 的能量变化如图所示,下列叙述中正确的是( )
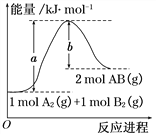
A.每生成2mol AB(g) 共吸收b kJ热量
B.该反应热ΔH = +(a-b) kJ·mol-1
C.反应物的总能量大于生成物的总能量
D.断裂1 mol A—A键,放出a kJ能量
【答案】B
【解析】
A.反应热△H=反应物能量总和-生成物能量总和,所以反应热△H=+(a-b)kJmol-1,则每生成2molAB吸收(a-b) kJ热量,故A错误;
B.反应热△H=反应物能量总和-生成物能量总和,所以反应热△H=+(a-b)kJmol-1,故B正确;
C.由图象可知,该反应中反应物的能量低于生成物的能量,反应是吸热反应,故C错误;
D.因旧键的断裂吸收能量,由图可知断裂1 mol A-A和1 mol B-B键吸收a kJ能量,故D错误;故选C。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案【题目】某同学帮助水质检测站配制480 mL 0.5 mol·L-1NaOH溶液以备使用。
(1)该同学用到的玻璃仪器除了烧杯、量筒、试剂瓶,还需要_________________。
(2)其操作步骤如下图所示,则如图操作应在下图中的_______(填选项字母)之间。
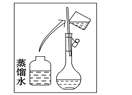
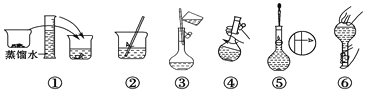
A.②与③ B.①与② C.④与⑤
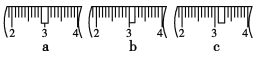
(3)该同学应称取NaOH固体________g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小__________(填字母)
a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |
并在下图中选出能正确表示游码位置的选项________(填字母)。
(4)下列操作对所配溶液的浓度大小有何影响?
① 转移完溶液后未洗涤玻璃棒和烧杯,浓度会_______(填“偏大”、“偏小”或“无影响”,下同)。
② 容量瓶中原来有少量蒸馏水,浓度会__________。
③ 以480mL溶液体积计算所需NaOH的质量_________。
④ 未冷却到室温就注入容量瓶定容_________。