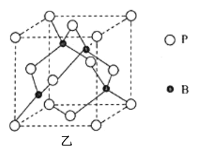
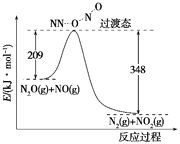
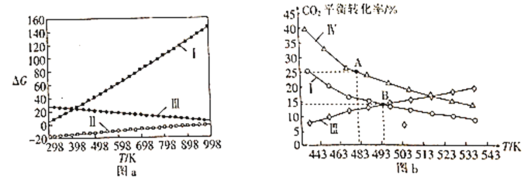
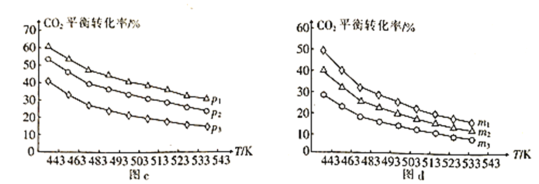
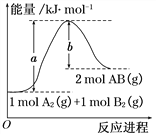
题目内容
【题目】复旦大学王永刚的研究团队制得一种柔性水系锌电池,该可充电电池以锌盐溶液作为电解液,其原理如图所示。下列说法不正确的是( )
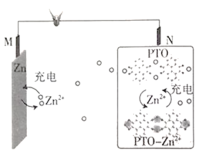
A.放电时,N极发生还原反应
B.充电时,Zn2+向M极移动
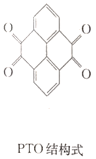
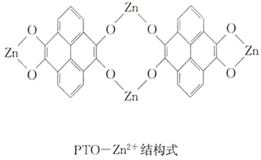
C.充电时,N极的电极反应式为2PTO+8e-+4Zn2+==PTO-Zn2+
D.放电时,每生成1molPTO-Zn2+,M极溶解![]() 的质量为260g
的质量为260g
【答案】C
【解析】
从图中可以看出,放电时,M极上Zn失电子生成Zn2+,M极为负极,则N极为正极;充电时,M极上Zn2+得电子生成Zn,M极为阴极,则N极为阳极。
A.放电时,N极为正极,得电子发生还原反应,A正确;
B.充电时,阳离子向阴极移动,M极为阴极,所以Zn2+向M极移动,B正确;
C.充电时,N极为阳极,电极反应式为PTO-Zn2+-8e- ==2PTO+4Zn2+,C不正确;
D.放电时,每生成![]() ,则转移电子8mol,M极溶解
,则转移电子8mol,M极溶解![]() 的质量为4mol×65g/mol=260g,D正确;
的质量为4mol×65g/mol=260g,D正确;
故选C。

【题目】某校学习小组的同学设计实验,制备(NH4)2Fe(SO4)26H2O并探究其分解规律。实验步骤如下:
Ⅰ.称取7.0g工业废铁粉放入烧杯中,先用热的Na2CO3溶液洗涤,再水洗,最后干燥。
Ⅱ.称取6.0g上述处理后的铁粉加入25mL某浓度硫酸中加热,加热过程中不断补充蒸馏水,至反应充分。
Ⅲ.冷却、过滤并洗涤过量的铁粉,干燥后称量铁粉的质量。
Ⅳ.向步骤Ⅲ的滤液中加入适量(NH4)2SO4晶体,搅拌至晶体完全溶解,经一系列操作得干燥纯净的(NH4)2Fe(SO4)26H2O。
V.将(NH4)2Fe(SO4)26H2O脱水得(NH4)2Fe(SO4)2,并进行热分解实验。
已知在不同温度下FeSO47H2O的溶解度如表:
温度(℃) | 1 | 10 | 30 | 50 |
溶解度(g) | 14.0 | 17.0 | 25.0 | 33.0 |
回答下列问题:
(1)步骤Ⅰ用热的Na2CO3溶液洗涤工业废铁粉的目的是__,步骤Ⅱ中设计铁粉过量,是为了__,加热反应过程中需不断补充蒸馏水的目的是__。
(2)步骤Ⅲ中称量反应后剩余铁粉的质量,是为了__。
(3)(NH4)2Fe(SO4)2分解的气态产物可能有N2、NH3、SO2、SO3及水蒸气,用下列装置检验部分产物。

①检验气态产物中的SO2和SO3时,装置连接顺序依次为__(气流从左至右);C中盛放的试剂为__。
②装置A的作用是__。
③检验充分分解并冷却后的瓷舟中铁的氧化物中是否含有二价铁,需用到的试剂为__。
【题目】某同学用某种粗盐进行提纯实验,步骤如下图所示。

请回答下列问题:
(1)步骤①和②的操作名称是________。
(2)步骤③判断加入盐酸“适量”的方法是__________________;步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止________________,当蒸发皿中有较多量固体出现时,应________,用余热使水分蒸干。
(3)猜想和验证:
猜想 | 验证方法 | 现象 | 结论 |
猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用内壁涂有澄清石灰水的小烧杯罩住试管口 | ________ | 猜想Ⅰ 成立 |
猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴加________,再滴加Na2SO4溶液 | 有气泡冒出,无白色沉淀 | ________ |
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体于试管中溶解,________ | ________ | 猜想Ⅲ 成立 |