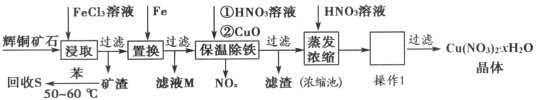
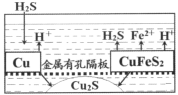
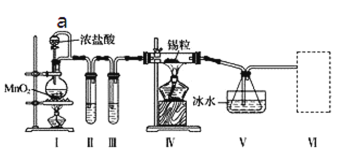
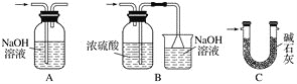
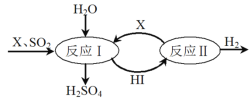
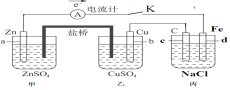
【题目】金属钛(Ti)被称为21世纪金属,在航海、航空、记忆和涂料方面应用广泛,TiO2是一种优良的光催化剂。20世纪科学家尝试用多种方法将金红石(TiO2)还原,发现金红石直接氯化是冶炼钛的关键。
步骤:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) ΔH=+1493kJmol-1,ΔS=+61JK-1mol-1
该反应发生温度高达2170℃,能耗大,对设备和生产要求几乎达到苛刻程度。目前科学家采用金红石加碳氯化方法,在较温和条件下成功制取TiCl4,为人类快速迈进钛合金时代做出了巨大贡献。金红石加碳氯化的主要反应如下:
反应Ⅰ:TiO2(s)+2Cl2(g) +C(s)![]() TiCl4(g)+CO2(g) ΔH1,ΔS1=+64JK-1mol-1
TiCl4(g)+CO2(g) ΔH1,ΔS1=+64JK-1mol-1
反应Ⅱ:TiO2(s)+2Cl2(g) +2C(s)![]() TiCl4(g)+2CO(g) ΔH2,△S2
TiCl4(g)+2CO(g) ΔH2,△S2
已知:①C(s)+O2(g)=CO2(g) ΔH=-394.3kJmol-1
②2C(s)+O2(g)=2CO(g) ΔH=-222.3kJmol-1
请回答:
(1)反应Ⅰ的ΔH1=__kJmol-1。
(2)对于气体参加的反应,表示平衡常数KP时,用气体组分B的平衡压强P(B)代替该气体物质的量浓度c(B),则反应Ⅰ的KP=__(用表达式表示)。
(3)在常温、常压、光照条件下,N2在催化剂TiO2表面与H2O发生反应,2N2(g)+6H2O(1)=4NH3(g)+3O2(g) ΔH=+1530.4kJmol-1
进一步研究相同条件下NH3生成量与温度的关系,部分实验数据见表:
实验组别 | 1 | 2 | 3 | 4 |
T/K | 303 | 313 | 323 | 353 |
NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
O2生成量/(10-6mol) | 3.6 | 4.4 | 4.5 | 1.5 |
反应时间/h | 3 | 3 | 3 | 3 |
容器体积/L | 2 | 2 | 2 | 2 |
①请在如图中画出上述反应在“有催化剂”与“无催化剂”两种情况下反应过程中体系能量随反应过程的变化趋势示意图(图中标明必要的文字说明)。___
②根据表中数据,在303K时,在3h内用氮气表示其平均反应速率为___molL-1h-1。判断组别4中反应是否达到平衡状态___(填“是”或“否”),并说明理由___。
【题目】对于反应A(g)![]() 2B(g) H>0,在温度为T1和T2时,平衡体系中B的体积分数随压强变化的曲线如图所示。
2B(g) H>0,在温度为T1和T2时,平衡体系中B的体积分数随压强变化的曲线如图所示。

(1)根据曲线图,下列说法不正确的是___。
A.a、c两点的反应速率:c>a
B.b、c两点A气体的转化率相等
C.由状态b到状态a,可以通过加热的方法
D.由状态b到状态c,可以通过加压的方法
(2)若上述反应在定容密闭容器中进行,达到平衡状态的标志是___。
A.单位时间内生成nmolA的同时分解2nmolB B.两种气体的体积分数不再改变
C.混合气体的密度不再发生变化 D.混合气体的质量不再发生变化
(3)若上述反应达平衡时,B气体的平衡浓度为0.1mol·L-1,通过减小体积来增大体系的压强(温度保持不变),重新达平衡后,B气体的平衡浓度___0.1mol·L-1(填“大于”、“小于”或“等于”)。
(4)在100℃时,将0.40mol的B气体充入2L密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如表的数据:
时间(s) | 0 | 20 | 40 | 60 | 80 |
n(B)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(A)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
上表中n3___n4(填“大于”、“小于”或“等于”),反应A(g)![]() 2B(g)在100℃时的平衡常数K的值为___,升高温度后,反应2B(g)
2B(g)在100℃时的平衡常数K的值为___,升高温度后,反应2B(g)![]() A(g)的平衡常数K的值___(填“增大”、“减小”或“不变”)。
A(g)的平衡常数K的值___(填“增大”、“减小”或“不变”)。