题目内容
【题目】大气污染物主要成分是SO2、NO2、NO、CO及可吸入颗粒等,主要来自于燃煤、机动车尾气和工业废气,会导致雾霾、酸雨等。
(1)汽车的三元催化转化器中,在催化剂作用下NO和CO转化为无毒气体,反应的化学方程式是: 2CO+2NO ![]() 2CO2+N2,该反应中,氧化剂是____________(填化学式),氧化产物是______________(填化学式),当生成2mol N2时,转移电子的物质的量是____________________。
2CO2+N2,该反应中,氧化剂是____________(填化学式),氧化产物是______________(填化学式),当生成2mol N2时,转移电子的物质的量是____________________。
(2)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”。控制溶液的pH=5.5,将烟气中的SO2转化为SO42―。已知0.1mol/L 100mLNaClO溶液,可以恰好吸收0.01moL SO2,则反应的离子方程式是______________________。
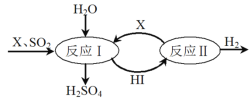
(3)SO2通过如图过程既能制得H2SO4又能制得H2。图中可循环利用的物质X是_________(填化学式),制得H2SO4的化学方程式是__________________________。
(4)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:NO2+NO+2NaOH===2NaNO2+H2O 2NO2+2NaOH===NaNO2+NaNO3+H2O
现有V L某NaOH溶液能完全吸收n mol NO2和m mol NO组成的大气污染物。所用烧碱溶液的物质的量浓度至少为________ mol·L1。若所得溶液中c(![]() )∶c(
)∶c(![]() )=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=____________________。
)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=____________________。
【答案】NO CO2 8mol ClO-+SO2+H2O=SO42-+Cl-+2H+ I2 SO2+I2+2H2O= H2SO4+2HI ![]() 3∶2
3∶2
【解析】
(1)化学反应中元素化合价降低的做氧化剂被还原生成还原产物,元素化合价升高的做还原剂被氧化生成氧化产物,结合化学方程式定量关系计算电子转移总数;
(2)NaClO溶液吸收烟气中SO2,发生氧化还原反应生成硫酸和氯化钠,结合电荷守恒和原子守恒书写离子方程式;
(3)反应Ⅰ是碘单质与二氧化硫反应生成硫酸和氢碘酸,反应的化学方程式为:Br2+SO2+2H2O=2HBr+H2SO4,反应Ⅱ是氢碘酸分解生成氢气和碘单质,2HBr![]() Br2+H2;
Br2+H2;
(4)①根据气体和氢氧化钠的关系式计算;
②根据二氧化氮、一氧化氮和氢氧化钠反应的方程式中各个物理量之间的关系式计算;
(1)反应的化学方程式是:2CO+2NO ![]() 2CO2+N2,氮元素化合价+2价降低为0价,NO做氧化剂,CO做还原剂被氧化得到氧化产物CO2,
2CO2+N2,氮元素化合价+2价降低为0价,NO做氧化剂,CO做还原剂被氧化得到氧化产物CO2,
故答案为:NO,CO2;
反应的化学方程式是:2CO+2NO![]() 2CO2+N2,元素化合价变化计算生成1mol氮气电子转移4e-,当生成2mol N2时,转移电子的物质的量是8mol,
2CO2+N2,元素化合价变化计算生成1mol氮气电子转移4e-,当生成2mol N2时,转移电子的物质的量是8mol,
故答案为:8mol;
(2)NaClO溶液吸收烟气中SO2,0.1mol/L 100mLNaClO溶液,可以恰好吸收0.01moL SO2,物质的量比为1:1,发生氧化还原反应生成硫酸和氯化钠,反应的离子方程式是:SO2+ClO-+H2O═SO42-+Cl-+2H+,
故答案为:SO2+ClO-+H2O═SO42-+Cl-+2H+;
(3)由图可知反应Ⅰ是碘单质与二氧化硫反应生成硫酸和氢碘酸,反应Ⅱ是氢碘酸分解生成氢气和碘单质,该过程可循环利用的物质是I2和HI,X为I2
故答案为:I2;
②反应Ⅰ是碘单质与二氧化硫反应生成硫酸和氢碘酸,反应的化学方程式:SO2+I2+2H2O═H2SO4+2HI,
故答案为:SO2+I2+2H2O═H2SO4+2HI;
(4)根据方程式2NO2+2NaOH=NaNO2+NaNO3+H2O和NO2+NO+2NaOH=2NaNO2+H2O知,只要NO不剩余,氮原子和氢氧化钠的关系式是1:1,所以完全吸收n mol NO2和m mol NO组成的混合气体所用氢氧化钠的物质的量等于氮氧化物的物质的量之和,所以n(NaOH)=![]() ,
,
故答案为:![]() ;
;
设原混合气体中NO2和NO的物质的量n和m,
NO2+NO+2NaOH=2NaNO2+H2O,
1 1 2
mmol mmol 2mmol
2NO2+2NaOH=NaNO2 + NaNO3+H2O,
2 1 1
(n-m)mol ![]() mol
mol ![]() mol
mol
所得溶液中c(NO3-):c(NO2-)=![]() mol:[2m+
mol:[2m+![]() mol]=1:9,
mol]=1:9,
所以n:m=3:2,
故答案为:3:2;