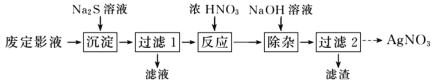
题目内容
【题目】过渡元素参与组成的新型材料有着广泛的用途,回答下列问题。
(1)基态铁原子核外共有________种不同空间运动状态的电子。铁、钴、镍基态原子中,核外未成对电子数最少的原子价层电子轨道表示式(电子排布图)为________。
(2)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和74pm,则熔点NiO________FeO(填“>”“<”或“=”),原因是________。
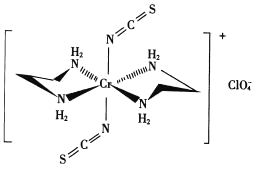
(3)Cr的一种配合物结构如图所示:
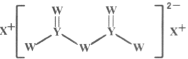
①阴离子![]() 的空间构型为________形。
的空间构型为________形。
②配离子中,中心离子的配位数为_______,N与中心原子形成的化学键称为_______键。
③配体H2NCH2CH2NH2(乙二胺)中碳原子的杂化方式是________,分子中三种元素电负性从大到小的顺序为________。
(4)一种新型材料的晶胞结构如图1所示,图2是晶胞中Sm和As原子的投影位置。
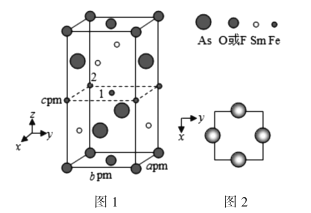
图1中F和O共同占据晶胞的上下底面位置,若两者的比例依次用x和1x代表,则该化合物的化学式表示为________,晶体密度ρ=________g·cm3(用含x的表达式表示,设阿伏加德罗常数的值为NA)。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标(![]() ),则原子2的坐标为________。
),则原子2的坐标为________。
【答案】15 ![]() > 相同电荷的离子,半径越小,离子键越强,晶格能就越大,熔点就越高 正四面体 6 配位 sp3 N>C>H SmFeAsO1-xFx
> 相同电荷的离子,半径越小,离子键越强,晶格能就越大,熔点就越高 正四面体 6 配位 sp3 N>C>H SmFeAsO1-xFx ![]() (0,0,
(0,0,![]() )
)
【解析】
根据铁原子的电子排布式确定空间运动状态的电子种类,由铁、钴,镍的价电子排布式确定未成对电子数。离子晶体的熔点与离子键强弱即离子所带电荷、离子半径长短有关来确定。根据VSEPR理论判断空间构型和杂化轨道方式。根据晶胞的结构分析晶体的化学式并进行相关的计算。
(1)铁为26号元素,基态铁原子核外电子排布式为:1s22s22p63s23p63d64s2,其核外有26种不同运动状态的电子,有1s、2s、3s、4s、2p、3p、3d共15种不同空间运动状态的电子;铁、钴、镍的价电子排布式分别为3d64s2、3d74s2、3d84s2,基态原子核外未成对电子数分别是4,3,2,最少的是Ni,其价层电子的电子排布图为![]() ;故答案为:15,
;故答案为:15,![]() 。
。
(2)NiO、FeO的晶体结构类型均与NaCl相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,晶格能越大,熔点越高,由于Ni2+和Fe2+所带电荷一样,Ni2+的离子半径小于Fe2+的离子半径,所以熔点是NiO>FeO;
答案为:>;相同电荷的离子,半径越小,离子键越强,晶格能就越大,熔点就越高。
(3)①阴离子C1O4-的价层电子对数=4+![]() =4,没有孤电子对,所以其空间构型为正四面体;
=4,没有孤电子对,所以其空间构型为正四面体;
答案为:正四面体;
②由图可知,与中心Cr形成的配位数为6;N元素提供孤电子对,Cr提供空轨道,所以N与中心原子形成的化学键称为配位键;
答案为:6;配位键;
③由H2NCH2CH2NH2可知,C周围形成了4个单键,即价层电子对数为4,碳原子的杂化方式为sp3;元素的非金属性越强,其电负性越大,同一周期元素,元素的电负性随着原子序数增大而增大,非金属性强弱顺序是N>C>H,所以C、N、H的电负性关系为:N>C>H;
答案为:sp3,N>C>H;
(4)该晶胞中,As原子个数=4×![]() =2、Sm原子个数=4×
=2、Sm原子个数=4×![]() =2、Fe原子个数=1+4×
=2、Fe原子个数=1+4×![]() =2、F-和O2-离子总数=8×
=2、F-和O2-离子总数=8×![]() +2×
+2×![]() =2,则该晶胞中As、Sm、Fe原子数目与F-和O2-离子总数个数之比=2:2:2:2=1:1:1:1,如果F-个数为x,则O2-个数为1-x,所以该化合物化学式为SmFeAsO1-xFx;该晶胞体积V=(a×10-10×b×10-10×c×10-10)cm3=abc×10-30cm3,晶体密度ρ=
=2,则该晶胞中As、Sm、Fe原子数目与F-和O2-离子总数个数之比=2:2:2:2=1:1:1:1,如果F-个数为x,则O2-个数为1-x,所以该化合物化学式为SmFeAsO1-xFx;该晶胞体积V=(a×10-10×b×10-10×c×10-10)cm3=abc×10-30cm3,晶体密度ρ=![]() =
=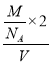 =
=![]()
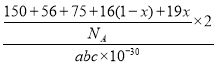 g/cm3=
g/cm3=![]() g/cm3;图1中原子1的坐标为(
g/cm3;图1中原子1的坐标为(![]() ,
,![]() ,
,![]() ),则原子2在x、y、z轴上的投影分别为0、0、
),则原子2在x、y、z轴上的投影分别为0、0、![]() ,所以原子2的坐标为(0,0,
,所以原子2的坐标为(0,0,![]() );
);
答案为:SmFeAsO1-xFx,![]() ,(0,0,
,(0,0,![]() )。
)。

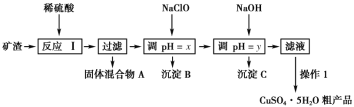
【题目】某矿渣的成分为Cu2O、Al2O3、Fe2O3、FeO、SiO2,工业上用该矿渣获取铜和胆矾的操作流程如图:
已知:①Cu2O+2H+=Cu+Cu2++H2O。
②部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 5.4 | 4.0 | 2.7 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.7 | 8.8 |
(1)为了加快反应Ⅰ的速率,可以采取的措施是__(任写1条)。
(2)固体混合物A中的成分是__。
(3)反应Ⅰ完成后,铁元素的存在形式为__(填离子符号);检验该离子常用的方法之一是:取少量含该离子的溶液于试管中,滴加几滴铁氰化钾溶液,会产生沉淀,写出该反应的离子方程式__。
(4)操作1主要包括:__、__、__。洗涤CuSO4·5H2O粗产品不能用大量水洗,而用冰水洗涤。原因是__。
(5)用NaClO调pH可以生成沉淀B,利用题中所给信息分析沉淀B为__,该反应中氧化剂与还原剂的物质的量之比为__。
(6)用NaOH调pH可以生成沉淀C,利用题中所给信息分析y的范围为__。