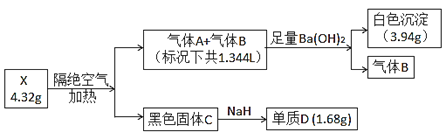
【题目】下列实验操作能达成实验目的且涉及到氧化还原反应的是( )
选项 | 实验目的 | 实验操作 |
A | 除去 | 先后通过盛有酸性 |
B | 除去 | 加入过量 |
C | 检验溶液中含有 | 加入 |
D | 检验稀硫酸催化淀粉水解的产物为葡萄糖 | 向水解后的溶液中直接加入新制 |
A.AB.BC.CD.D
【题目】与化学平衡类似,电离平衡的平衡常数,叫做电离常数(用K表示)。下表是某温度下几种常见弱酸的电离平衡常数:
酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | 2×10﹣5 |
HClO | HClO | 3.0×10﹣8 |
H2CO3 | H2CO3 HCO3﹣ | K1=4.4×10﹣7 K2=5.61×10﹣11 |
H3PO4 | H3PO4 H2PO4﹣ HPO42﹣ | K1=7.1×10﹣3 K2=6.3×10﹣8 K3=4.2×10﹣13 |
回答下列问题:
(1)若把CH3COOH、HClO、H2CO3、HCO3﹣、H3PO4、H2PO4﹣、HPO42﹣都看作是酸,则它们酸性最强的是_______(填化学式,下同),最弱的是________。
(2)向NaClO溶液中通入少量的二氧化碳,发生的离子方程式为_______。
(3)求出该温度下,0.10molL﹣
(4)该温度下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是____。
A.c(H+) B.c(H+)c(CH3COO﹣) C.c(H+)c(OH﹣) D.c(OH﹣)/c(H+)
(5)取等体积的pH均为a的醋酸和次氯酸两溶液,分别用等浓度的NaOH稀溶液恰好中和,消耗的NaOH溶液的体积分别为V1,V2,则大小关系为:V1_____V2( 填“>”、“<”或“=”)。
(6)下列四种离子结合H+能力最强的是_______。
A.HCO3﹣ B.CO32﹣ C.ClO﹣ D.CH3COO﹣
(7)等物质的量的苛性钠分别用pH为2和3的醋酸溶液中和,设消耗醋酸溶液的体积依次为Va、Vb,则两者的关系正确的是(_________)
A.Va>10Vb B.Va<10Vb C.Vb <10 Va D.Vb>10Va