题目内容
【题目】某温度时,在0.5L密闭容器中,某一可逆反应的A、B气体物质的量随时间变化的曲线如图所示,由图中数据分析可得:
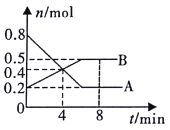
(1)该反应的化学方程式为____。
(2)若降低温度,则该反应的正反应速率______,逆反应速率______(均填“加快”“减慢”或“不变”)。
(3)第4min时,正、逆反应速率的大小关系为:v(正)______v(逆)(填“>”、“<”或“=”)。
(4)反应至4min时,A的转化率______。
(5)能判断该反应在一定温度下达到化学平衡状态的依据是_____(填字母代号)。
A.v(A)=2v(B)
B.容器内压强不再发生变化
C.容器内气体密度不再发生变化
D.B的体积分数不再发生变化
E.容器内气体原子总数不再发生变化
F.相同时间内消耗2nmol的A的同时生成nmol的B
【答案】2A![]() B 减慢 减慢 > 50% BD
B 减慢 减慢 > 50% BD
【解析】
由图可知,从反应开始,A的物质的量减少,B的物质的量增加,最后AB的物质的量均不变且不为0,则A为反应物、B为生成物,为可逆反应,根据反应的各物质的物质的量之比=化学计量数之比判断反应的方程式,再结合平衡状态的特征和影响化学反应速率的因素分析解答。
(1)由图可知,从反应开始,A的物质的量减少,B的物质的量增加,则A为反应物、B为生成物,开始至平衡时,A减少0.8mol-0.2mol=0.6mol,B增加0.5mol-0.2mol=0.3mol,由反应的物质的量之比等于化学计量数之比可知,A、B的化学计量数比为2∶1,且后来达到平衡状态,则反应为2AB,故答案为:2AB;
(2)降低温度,正逆反应速率均减小,故答案为:减慢;减慢;
(3)第4min时,反应尚未达到化学平衡,反应仍需向右进行,所以v正>v逆,故答案为:>;
(4)4min时,参加反应的A为0.8mol-0.4mol=0.4mol,则A的转化率=![]() ×100%=50%,故答案为:50%;
×100%=50%,故答案为:50%;
(5)A.根据方程式,任何时刻都存在v(A)=2v(B),不能说明达到平衡状态,故A不选;B.反应前后气体分子数不等,体系的压强为变量,容器中压强不变,可以说明化学反应达到化学平衡,故B选;C.容器中气体密度=ρ=![]() ,反应前后质量守恒,m不变,容器体积V不变,则整个反应过程容器中气体密度不变,不能说明化学反应是否达到化学平衡,故C不选;D.B的体积分数不再发生变化,不是B的物质的量不再变化,说明化学反应达到化学平衡,故D选;E.根据质量守恒定律,容器内气体原子总数始终不变,不能说明达到化学平衡,故E不选;F.根据方程式,相同时间内消耗2nmol的A的同时一定生成nmol的B,不能说明达到化学平衡,故F不选;故答案为:BD。
,反应前后质量守恒,m不变,容器体积V不变,则整个反应过程容器中气体密度不变,不能说明化学反应是否达到化学平衡,故C不选;D.B的体积分数不再发生变化,不是B的物质的量不再变化,说明化学反应达到化学平衡,故D选;E.根据质量守恒定律,容器内气体原子总数始终不变,不能说明达到化学平衡,故E不选;F.根据方程式,相同时间内消耗2nmol的A的同时一定生成nmol的B,不能说明达到化学平衡,故F不选;故答案为:BD。

 名校课堂系列答案
名校课堂系列答案【题目】下表为短周期元素,表中所列序号分别代表一种元素。(除说明外都用化学用语填空)
① | ② | |||||||
③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
(1)上述元素中金属性最强和非金属性最强的元素名称分别是______,_______;
(2)①和②的气态氢化物稳定性比较(写化学式):______________;
(3)在上述元素中其最高价氧化物对应水化物酸性最强的酸为_________;写出⑤单质与③的最高价氧化物对应水化物反应的化学方程式为____________ 。描述H2在⑧单质中燃烧的现象___________________;
(4)现有上表中某一种元素,其单质通入到紫色石蕊溶液中的现象为先变红后褪色,该元素在周期表中的位置是_________________;
(5)比较②和③对应简单离子的离子半径大小(用相应离子符号表示)________;
(6)写出③的最高价氧化物对应水化物的电子式___________;其含有的化学键类型是____________。