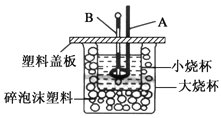
题目内容
【题目】为探究某难溶性盐X(仅含三种常见元素)的组成,设计并完成以下实验(流程中部分物质已略去):
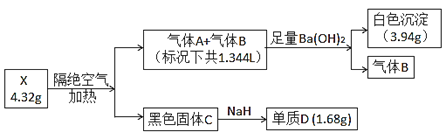
已知:气体A和气体B所含元素相同,都是无色无味气体,固体C为纯净物且具有磁性,单质D是目前建筑行业应用最广泛的金属。根据上述信息,回答下列问题:
(1)盐X的化学式为________________。
(2)无水条件下,少量NaH就能与固体C反应并放出大量的热,写出该反应的化学方程式___________________。
(3)将产生的气体A全部被100 mL 0.35 mol·L-1氢氧化钠溶液充分吸收,反应的总离子方程式为____________________。
【答案】FeC2O4 Fe3O4+4NaH =3Fe +4NaOH 4CO2+7OH—=3CO32—+HCO3—+3H2O
【解析】
固体C为纯净物且具有磁性,单质D是目前建筑行业应用最广泛的金属,且D和NaH反应得到D,则D为Fe,C为Fe3O4;气体A和气体B所含元素相同,都是无色无味气体,且将这两种气体通入到足量的Ba(OH)2溶液中,产生白色沉淀,B不反应,则A为CO2,B为CO;D的质量为1.68g,则4.32g X含Fe的物质的量为0.03mol,受热分解产生0.01mol Fe3O4;白色沉淀BaCO3的质量为3.94g,则根据碳元素守恒可以得知,n(CO2)=![]() =0.02mol;X受热分解产生的CO、CO2的体积为1.344L(标况),则n(CO)+n(CO2)=
=0.02mol;X受热分解产生的CO、CO2的体积为1.344L(标况),则n(CO)+n(CO2)=![]() =0.06mol,故n(CO)=0.04mol;综上所述,4.32g X经隔绝空气加热分解产生0.01mol Fe3O4、0.02mol CO2、0.04mol CO,则4.32g X含0.03mol Fe、0.06mol C、0.12mol O,故X的化学式为FeC2O4。
=0.06mol,故n(CO)=0.04mol;综上所述,4.32g X经隔绝空气加热分解产生0.01mol Fe3O4、0.02mol CO2、0.04mol CO,则4.32g X含0.03mol Fe、0.06mol C、0.12mol O,故X的化学式为FeC2O4。
(1)经分析,X的化学式为FeC2O4;
(2)根据题中的信息,可以推出该反应的化学方程式为:Fe3O4+4NaH=3Fe+4NaOH;
(3)经分析,气体A(CO2)的物质的量为0.02mol,n(NaOH)=0.1L× 0.35mol·L-1=0.035mol,
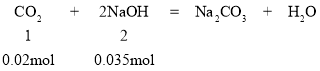
则CO2过量,即该过程涉及两个化学反应:CO2+2NaOH=Na2CO3+H2O,CO2+Na2CO3+H2O=2NaHCO3,从量上0.035nol NaOH和0.0175mol CO2反应生成0.0175mol Na2CO3,接着剩余的0.0025mol CO2消耗0.0025mol Na2CO3生成0.005mol NaHCO3,Na2CO3还剩0.015mol,所以0.02mol CO2和0.035mol NaOH反应生成了0.015mol Na2CO3、0.005mol NaHCO3,故该反应的化学方程式为:4CO2+7NaOH=3Na2CO3+NaHCO3+3H2O,离子方程式为:4CO2+7OH-=3CO32-+HCO3-+3H2O。

 名校课堂系列答案
名校课堂系列答案【题目】维持pH的稳定对生命体的生理活动、化学电源的高效工作等具有重要意义。
(1)常温下,在不同试剂中加入酸或碱后体系pH的变化如下表所示。
试剂 | pH | ||
初始 | 通入0.01 mol HCl气体 | 加入0.01 mol NaOH固体 | |
i.1 L H2O | 7 | a | 12 |
ii.0.10 mol CH3COOH+0.10 mol CH3COONa配制成1 L的溶液 | 4.76 | 4.67 | 4.85 |
①a=____________(忽略通入HCl气体前后体系的体积变化)。
②结合化学用语解释试剂ii显酸性的原因:____________。
③试剂ii中微粒浓度关系正确的有____________(填序号)。
a. c(CH3COOH)>c(Na+)>c(CH3COO-)
b. 2c(H+)=c(CH3COO-)-c(CH3COOH)+2c(OH-)
c. c(CH3COOH)+c(CH3COO-)=0.2 mol/L
④由表中数据可知,试剂ii的pH受一定量的酸和碱的影响不大。溶液的这种能对抗外来少量强酸、强碱或适当稀释,而保持溶液的pH几乎不变的作用称为缓冲作用。下列溶液具有缓冲作用的是____________(填序号)。
a. HCl—NaCl b. Na2CO3—NaHCO3 c. NH3·H2O-NH4Cl d. KOH—KCl
(2)缓冲溶液应用在某种液钒电池中能稳定电池的输出电流,该电池装置示意图如下图所示,电池的总反应如下:
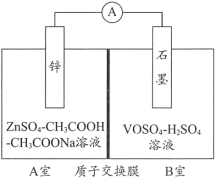
Zn+2VOSO4+2H2SO4![]() ZnSO4+V2(SO4)3+2H2O
ZnSO4+V2(SO4)3+2H2O
已知:VOSO4和V2(SO4)3的电离方程式分别为VOSO4=VO2++SO42-;V2(SO4)3=2V3++3SO42-;
①放电时,B室中c(H+)____________(填“增大”“减小”或“不变”),结合化学用语说明理由:______。
②充电时,A室中的c(H+)变化缓慢的原因是____________。