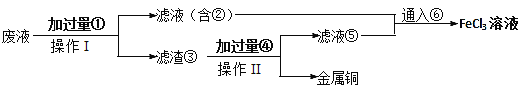
题目内容
【题目】化学基本概念是学习化学的基石,请正确回答下列问题。
(1)今有7种物质:①液态氯化氢 ②乙醇 ③熔融的KNO3 ④铜线 ⑤NaCl晶体 ⑥小苏打溶液 ⑦氨水。属于电解质的是___________,属于非电解质的是_____________。将①加入到⑦中,⑦的导电能力_______(填“增强”、“减弱”或“基本不变”)。
(2)漂白粉中加入盐酸,可产生氯气,化学方程式为:Ca(ClO)2+4HCl = CaCl2 +2Cl2+2H2O。用双线桥法表示该反应中电子转移的方向和数目_________,当有0.1 mol电子发生转移时,生成氯气的体积为_______L(标况下),被氧化的HCl为______mol。
(3)“四种基本反应类型与氧化还原反应的关系”如图所示:
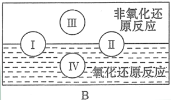
其中Ⅰ为化合反应,Ⅳ是_________反应。现有以下反应模型:单质A + 氧化物B=单质C + 氧化物D(A、B、C、D均为中学阶段常见物质,反应条件已略去),写出符合上述反应模型的化学反应方程式。
①若A为金属单质,B为非金属氧化物:_________________________。
②若A和C均为固体非金属单质:_______________________________。
(4)浓硫酸有强氧化性,常温下,向碳素钢(仅含铁、碳元素的合金)中加入少量浓硫酸,无明显现象,原因是:____________________,加热后,可能产生的气体有___________________。
【答案】①③⑤ ② 增强 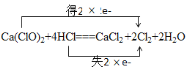 2.24 0.1 置换 2Mg+CO2
2.24 0.1 置换 2Mg+CO2![]() 2MgO+C 2C+SiO2
2MgO+C 2C+SiO2![]() Si+2CO↑ ①常温下C和浓硫酸不反应,②常温下铁在浓硫酸中钝化 CO2、SO2、H2
Si+2CO↑ ①常温下C和浓硫酸不反应,②常温下铁在浓硫酸中钝化 CO2、SO2、H2
【解析】
(1)①液态氯化氢在水中可以发生电离,该物质是电解质;
②乙醇在水中或者熔融状态下不能电离,该物质是非电解质;
③熔融的KNO3可以导电,该物质是电解质;
④铜线可以导电,但该物质属于单质,不属于电解质的研究范畴,故该物质既不是电解质,也不是非电解质;
⑤NaCl晶体在溶液中或者熔融状态下可以电离,该物质是电解质;
⑥小苏打溶液是混合物,不属于电解质的研究范畴,故该物质既不是电解质,也不是非电解质;
⑦氨水是混合物,不属于电解质的研究范畴,故该物质既不是电解质,也不是非电解质;
故属于电解质的是①③⑤;属于非电解质的是②;
⑦氨水中的NH3·H2O是弱电解质,在水中不能完全电离,加入①液态氯化氢之后,生成强电解质NH4Cl,溶液导电性会增强;
(2)该反应的电子转移方程式为: ,根据电子转移方程式可知:每生成2份Cl2,转移2份电子,需要4份HCl,有2份HCl作还原剂,有2则转移0.1mol电子,生成0.1mol Cl2,即2.24L(标况),被氧化的HCl有0.1mol;
,根据电子转移方程式可知:每生成2份Cl2,转移2份电子,需要4份HCl,有2份HCl作还原剂,有2则转移0.1mol电子,生成0.1mol Cl2,即2.24L(标况),被氧化的HCl有0.1mol;
(3)四大基本反应类型中,置换反应中一定有化合价变化,一定是氧化还原反应;化合反应、分解反应中,有的有化合价变化,有的没有化合价变化,故部分化合反应、分解反应属于氧化还原反应;复分解反应没有化合价的变化,一定不是氧化还原反应;故若I为化合反应,II为分解反应,III为复分解反应,IV为置换反应;
符合题中反应模型的化学反应方程式,①2Mg+CO2![]() 2MgO+C;②2C+SiO2
2MgO+C;②2C+SiO2![]() =Si+2CO↑;
=Si+2CO↑;
(4)常温下,C和浓硫酸不反应,铁在浓硫酸中钝化,故无明显现象;加热后,C、Fe会和浓硫酸反应生成CO2、SO2,随着反应的进行,浓硫酸会变为稀硫酸,则未被氧化的Fe还会和稀硫酸反应生成H2,故可能生成的气体有CO2、SO2、H2。

 阶梯计算系列答案
阶梯计算系列答案【题目】下列实验操作能达成实验目的且涉及到氧化还原反应的是( )
选项 | 实验目的 | 实验操作 |
A | 除去 | 先后通过盛有酸性 |
B | 除去 | 加入过量 |
C | 检验溶液中含有 | 加入 |
D | 检验稀硫酸催化淀粉水解的产物为葡萄糖 | 向水解后的溶液中直接加入新制 |
A.AB.BC.CD.D
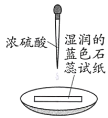
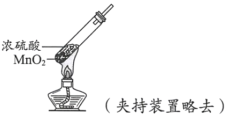
【题目】下列依据实验方案和现象对浓硫酸性质做出的判断合理的是
实验方案 | 实验I: | 实验II: |
实验现象 | 试纸中心区域变黑,边缘变红 | 黑色固体溶解,溶液接近无色(溶液中锰元素仅以 |
A.由I可知,浓硫酸具有脱水性B.由I可知,浓硫酸具有弱酸性
C.由II可知,浓硫酸具有强氧化性D.由II可知,浓硫酸具有吸水性