题目内容
【题目】某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+又含有Fe3+。将一定量的该磁黄铁矿与盐酸完全反应(注:矿石中其他成分不与盐酸反应),生成2.4 g硫单质、0.425 mol FeCl2和一定量H2S气体,且溶液中滴加KSCN溶液不变血红色。请计算并回答下列问题:
(1)该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为_____________。
(2)该磁黄铁矿FexS中,x=_________________。
【答案】11∶6 0.85
【解析】
根据题中信息,可以推出FexS为FeS和Fe2S3的混合物;向该该磁黄铁矿中加入盐酸,发生反应FeS+2HCl=FeCl2+H2S↑,Fe2S3+4HCl=2FeCl2+2H2S↑+S↓;且反应后的溶液中滴加KSCN溶液不变血红色,说明溶液中不含Fe3+,再根据题中给出的数据分析计算即可。
根据题中信息,可以推出FexS为FeS和Fe2S3的混合物;向该该磁黄铁矿中加入盐酸,发生反应FeS+2HCl=FeCl2+H2S↑,Fe2S3+4HCl=2FeCl2+2H2S↑+S↓;根据题中信息可得,n(S)=![]() =0.075mol,n(FeCl2)=0.425mol,根据反应Fe2S3+4HCl=2FeCl2+2H2S↑+S↓可以计算得到n(Fe2S3)=0.075mol,n(FeCl2)2=0.15mol,则n(FeCl2)1=0.425mol-0.15mol=0.275mol,根据反应FeS+2HCl=FeCl2+H2S↑可以计算得到n(FeS)= n(FeCl2)1=0.275mol,则该磁黄铁矿FexS中,含0.275mol FeS和0.075mol Fe2S3,故Fe2+与Fe3+的物质的量之比为0.275mol:(2×0.075mol)=11:6;该磁黄铁矿FexS中,含Fe 0.425mol,S 0.5mol,则
=0.075mol,n(FeCl2)=0.425mol,根据反应Fe2S3+4HCl=2FeCl2+2H2S↑+S↓可以计算得到n(Fe2S3)=0.075mol,n(FeCl2)2=0.15mol,则n(FeCl2)1=0.425mol-0.15mol=0.275mol,根据反应FeS+2HCl=FeCl2+H2S↑可以计算得到n(FeS)= n(FeCl2)1=0.275mol,则该磁黄铁矿FexS中,含0.275mol FeS和0.075mol Fe2S3,故Fe2+与Fe3+的物质的量之比为0.275mol:(2×0.075mol)=11:6;该磁黄铁矿FexS中,含Fe 0.425mol,S 0.5mol,则![]() ,x=0.85。
,x=0.85。

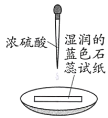
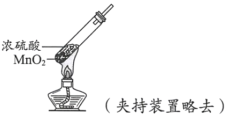
【题目】下列依据实验方案和现象对浓硫酸性质做出的判断合理的是
实验方案 | 实验I: | 实验II: |
实验现象 | 试纸中心区域变黑,边缘变红 | 黑色固体溶解,溶液接近无色(溶液中锰元素仅以 |
A.由I可知,浓硫酸具有脱水性B.由I可知,浓硫酸具有弱酸性
C.由II可知,浓硫酸具有强氧化性D.由II可知,浓硫酸具有吸水性