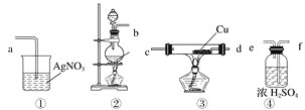
【题目】以含锂电解铝废渣(主要成分为LiF、AlF3、NaF,少量CaO等)为原料,生产高纯度LiOH的工艺流程如图:(已知:常温下,LiOH可溶于水,Li2CO3微溶于水)
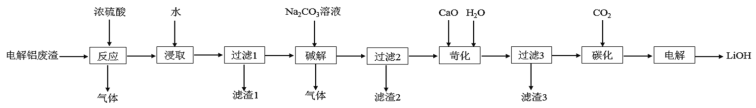
(1)含锂电解铝废渣与浓硫酸在200~400℃条件下反应2h。“滤渣1”主要成分是___(填化学式)。
(2)“过滤2”需要趁热在恒温装置中进行,否则会导致Li2SO4的收率下降,原因是___。
(已知部分物质的溶解度数据见下表)
温度/℃ | Li2SO4/g | Al2(SO4)3/g | Na2SO4/g |
0 | 36.1 | 31.2 | 4.9 |
10 | 35.4 | 33.5 | 9.1 |
20 | 34.8 | 36.5 | 19.5 |
30 | 34.3 | 40.4 | 40.8 |
40 | 33.9 | 45.7 | 48.8 |
(3)40°C下进行“碱解”,得到粗碳酸锂与氢氧化铝的混合滤渣,生成氢氧化铝的离子方程式为___;若碱解前滤液中c(Li+)=4molL-1,加入等体积的Na2CO3溶液后,Li+的沉降率到99%,则“滤液2”中c(CO32-)=___molL-1。[Ksp(Li2CO3)=1.6×10-3]
(4)“苛化”过程,若氧化钙过量,则可能会造成___。
(5)整个工艺流程中可以循环利用的物质有___。
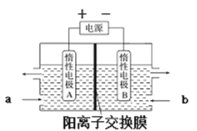
(6)“电解”原理如图所示。“碳化”后的电解液应从(填“a”或“b”)___口注入。阴极的电极反应式为___。
(7)高纯度LiOH可转化为电池级Li2CO3。将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式为___。
【题目】碘酸钙[Ca(IO3)2]广泛用于食品工业、口腔洗涤,防腐等领域,某化学兴趣小组在实验室利用碘在酸性条件下被氯酸钾氧化成碘酸氢钾(KIO3·HIO3),溶液经氢氧化钾中和后,与氯化钙发生复分解反应制备碘酸钙,其制备步骤及装置(水浴加热装置略去)如图: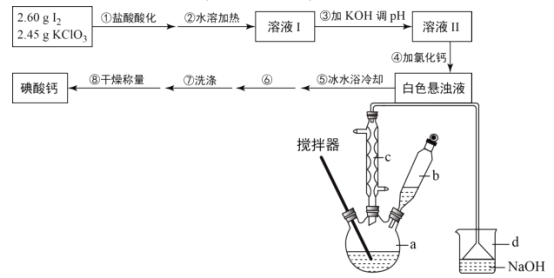
物质的摩尔质量如下表:
物质 | I2 | KClO3 | Ca(IO3)2 |
摩尔质量/g·mol-1 | 354 | 122.5 | 390 |
请回答下列问题:
(1)加入b中盐酸后,碘在酸性条件下被氯酸钾氧化成碘酸氢钾(KIO3·HIO3),反应中有黄绿色的气体生成,该反应的化学方程式为___。
(2)步骤②与“直接加热”相比,“水浴加热”的优点为___。
(3)步骤④加入氯化钙后,得到白色悬浊液,说明KIO3的溶解度___(填“大于”“小于”或“等于”)Ca(IO3)2。
(4)步骤⑤冰水浴冷却的目的为___。
(5)步骤⑥的操作名称为___。
(6)步骤⑦洗涤后检验沉淀是否洗涤干净的方法为___。
(7)最终得到2..60g碘酸钙产品,则产率为___ %(保留2小数)。
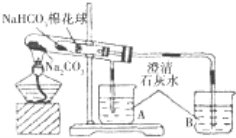
【题目】某小组同学通过对比实验了解Na2CO3和NaHCO3性质的异同,下表是他们撰写的实验报告的一部分。
① | 在贴有标签a、b的试管中分别加入1.0g Na2CO3固体和NaHCO3固体,观察外观。 | / |
② | 继续向两试管中分别加入10.0mL水,用力振荡,观察现象。 | / |
③ | 再分别向两试管中滴加2滴酚酞溶液,观察现象。 | 溶液均变红,颜色较深的试管是 (填 “a”或“b”)。 |
④ | 最后分别向两溶液中滴加足量盐酸。 | 红色褪去,均有无色气体产生.经计算生成气体的是a b(填“>”“<”或“=”)。 |
⑤ | 加热大试管一段时间。(注:棉花球沾有无水硫酸铜粉末)
| / |
(1)请帮助该小组同学完成实验报告中放入内容_____________。
(2)已知:20℃时Na2CO3的溶解度为20.5g。由实验_______(填实验序号)现象可知,20℃时NaHCO3的溶解度小于20.5g;如果向饱和Na2CO3溶液中不断通入CO2气体,现象是________,化学方程式是_________。
(3)由实验⑤可以得出结论是_______,用化学方程式说明得出结论的原因______。