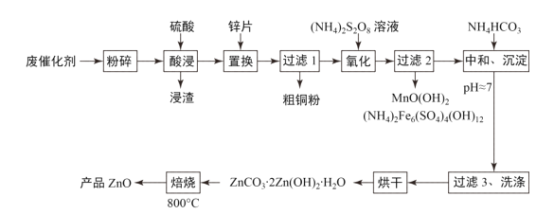
题目内容
【题目】某小组同学通过对比实验了解Na2CO3和NaHCO3性质的异同,下表是他们撰写的实验报告的一部分。
① | 在贴有标签a、b的试管中分别加入1.0g Na2CO3固体和NaHCO3固体,观察外观。 | / |
② | 继续向两试管中分别加入10.0mL水,用力振荡,观察现象。 | / |
③ | 再分别向两试管中滴加2滴酚酞溶液,观察现象。 | 溶液均变红,颜色较深的试管是 (填 “a”或“b”)。 |
④ | 最后分别向两溶液中滴加足量盐酸。 | 红色褪去,均有无色气体产生.经计算生成气体的是a b(填“>”“<”或“=”)。 |
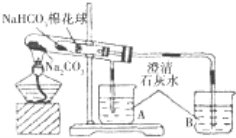
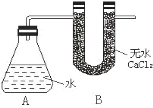
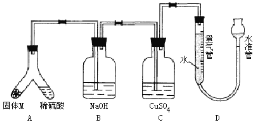
⑤ | 加热大试管一段时间。(注:棉花球沾有无水硫酸铜粉末)
| / |
(1)请帮助该小组同学完成实验报告中放入内容_____________。
(2)已知:20℃时Na2CO3的溶解度为20.5g。由实验_______(填实验序号)现象可知,20℃时NaHCO3的溶解度小于20.5g;如果向饱和Na2CO3溶液中不断通入CO2气体,现象是________,化学方程式是_________。
(3)由实验⑤可以得出结论是_______,用化学方程式说明得出结论的原因______。
【答案】a;<; ② 白色晶体析出 Na2CO3+CO2+H2O=2NaHCO3↓ 碳酸钠的稳定性强于碳酸氢钠 2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
【解析】
(1)③同温下,相同浓度下,碳酸钠的水解程度大,碱性强;
④根据n=![]() ,结合方程式可知:质量相同的碳酸钠和碳酸氢钠,碳酸钠产生的CO2比碳酸氢钠产生的CO2少;
,结合方程式可知:质量相同的碳酸钠和碳酸氢钠,碳酸钠产生的CO2比碳酸氢钠产生的CO2少;
(2)溶解度的高低需要看加水溶解的情况,由实验③现象可知,饱和碳酸钠转变成了碳酸氢钠有白色沉淀生成;
(3)无水CuSO4遇H2O变蓝,CO2能使澄清石灰水变浑浊,根据棉花球变蓝,说明产生了水,烧杯变浑浊,说明生成了CO2,因此说明碳酸钠的稳定性强于碳酸氢钠。
(1)③碳酸钠水解的离子方程式为CO32-+H2O![]() HCO3-+OH-,HCO3-+H2O
HCO3-+OH-,HCO3-+H2O![]() H2CO3+OH-;碳酸氢钠水解的离子方程式为HCO3-+H2O
H2CO3+OH-;碳酸氢钠水解的离子方程式为HCO3-+H2O![]() H2CO3+OH-;同温下,相同浓度下,CO32-水解程度大于HCO3-的水解程度,所以碳酸钠溶液的pH大于碳酸氢钠溶液的pH,酚酞遇碱变红,碱性越强,红色越深,因此颜色较深的试管是a;
H2CO3+OH-;同温下,相同浓度下,CO32-水解程度大于HCO3-的水解程度,所以碳酸钠溶液的pH大于碳酸氢钠溶液的pH,酚酞遇碱变红,碱性越强,红色越深,因此颜色较深的试管是a;
④Na2CO3、NaHCO3与盐酸反应的化学方程式为:Na2CO3+2HCl=2NaCl+CO2↑+H2O,NaHCO3+HCl=NaCl+CO2↑+H2O,根据方程式可知:产生1molCO2,需要Na2CO3质量是106g,需要NaHCO3质量是84g,可见相同的碳酸钠和碳酸氢钠,碳酸钠产生的CO2比碳酸氢钠产生的CO2少;
(2)溶解度的高低需要看加水溶解的情况,因此实验②说明了溶解度的高低;Na2CO3+CO2+H2O=2NaHCO3↓,饱和碳酸钠转变成了碳酸氢钠,因为碳酸钠的溶解度大于碳酸氢钠的溶解度,因此有白色沉淀生成;
(3)Na2CO3的热稳定性强于NaHCO3,NaHCO3分解反应方程式为:2NaHCO3![]() Na2CO3+CO2↑+H2O,无水CuSO4遇H2O变蓝,产生的CO2能使澄清石灰水变浑浊,因此现象是棉花球变蓝,A烧杯中没有明显现象,B烧杯中有白色沉淀产生,根据实验现象,棉花球变蓝,说明产生了水,烧杯变浑浊,说明生成了CO2,说明碳酸钠的稳定性强于碳酸氢钠。
Na2CO3+CO2↑+H2O,无水CuSO4遇H2O变蓝,产生的CO2能使澄清石灰水变浑浊,因此现象是棉花球变蓝,A烧杯中没有明显现象,B烧杯中有白色沉淀产生,根据实验现象,棉花球变蓝,说明产生了水,烧杯变浑浊,说明生成了CO2,说明碳酸钠的稳定性强于碳酸氢钠。