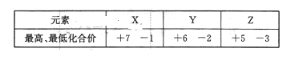
题目内容
【题目】为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如图所示的实验装置,按要求回答下列问题。
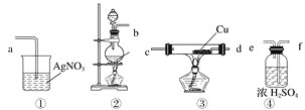
(1)请根据甲同学的示意图,所需实验装置从左至右的连接顺序:装置②→__________。
(2)装置②中主要玻璃仪器的名称__________、__________、__________。
(3)实验室制备Cl2的离子方程式为____________。
(4)装置③中Cu的作用__________(用化学方程式表示)。
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置⑤,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置⑤应放入__________。
(6)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成紫色石蕊试液,如果观察到__________的现象,则证明制Cl2时有HCl挥发出来。
【答案】(1)④③①(2)圆底烧瓶、分液漏斗、酒精灯(3)MnO2+4H++2Cl-![]() Mn2++ Cl2↑+2H2O
Mn2++ Cl2↑+2H2O
(4)Cu + Cl2![]() CuCl2(5)湿润的KI淀粉 (6)溶液只变红,不褪色
CuCl2(5)湿润的KI淀粉 (6)溶液只变红,不褪色
【解析】
试题(1)实验目的为证明实验室制备的氯气中含有氯化氢,所以先制备氯气,然后除去氯气中的水蒸气,再除去氯气,最后检验氯化氢,所以用浓硫酸除水,用铜除去氯气,用硝酸银检验氯化氢,所以顺序为④③①。(2)装置②酯制备氯气的发生装置,玻璃仪器有圆底烧瓶、分液漏斗、酒精灯。(3)实验室中用二氧化锰和浓盐酸在加热的条件下反应生成氯化锰和氯气和水,离子方程式为:MnO2+4H++2Cl-![]() Mn2++ Cl2↑+2H2O。(4)铜和氯气反应生成氯化铜。方程式为Cu + Cl2
Mn2++ Cl2↑+2H2O。(4)铜和氯气反应生成氯化铜。方程式为Cu + Cl2![]() CuCl2。(5)①装置是微粒检验氯化氢气体,为了确保实验结论的可靠性应排除氯气的干扰,在③吸收氯气之后要检验氯气是否完全除去,根据氯气的氧化性分析,可以用湿润的KI淀粉,若使淀粉碘化钾试纸变蓝,说明还有氯气,若不变蓝,则说明氯气完全除去。(6)若硝酸银溶液改为紫色石蕊溶液,氯化氢溶于水显酸性,会使石蕊变化,但有氯气会先变红后褪色,若溶液只变红,不褪色,说明气体为氯化氢气体,不是氯气。
CuCl2。(5)①装置是微粒检验氯化氢气体,为了确保实验结论的可靠性应排除氯气的干扰,在③吸收氯气之后要检验氯气是否完全除去,根据氯气的氧化性分析,可以用湿润的KI淀粉,若使淀粉碘化钾试纸变蓝,说明还有氯气,若不变蓝,则说明氯气完全除去。(6)若硝酸银溶液改为紫色石蕊溶液,氯化氢溶于水显酸性,会使石蕊变化,但有氯气会先变红后褪色,若溶液只变红,不褪色,说明气体为氯化氢气体,不是氯气。

 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案【题目】下图为元素周期表的一部分,根据元素a~j在周期表中的位置,按要求回答下列问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | a | |||||||
2 | b | c | d | e | ||||
3 | f | g | h | i | j | |||
(1)在a ~j中,化学性质最不活泼的元素是___________(填元素符号)。
(2)f、g、h的单质分别与水反应,最剧烈的是___________(填元素符号)。
(3)c、i的氢化物稳定性较强的是____________(填化学式)。
(4)c、f可形成既含离子键又含非极性键的化合物,该化合物的电子式为__________。
(5)d、f、g的离子半径最大的是_______________(填离子符号)。
(6)f的最高价氧化物的水化物与h的最高价氧化物的水化物反应的离子方程式为:___________________________________。