题目内容
【题目】合成氨反应是重要的化工反应,请回答下列问题:
(1)①NH3(g)+![]() O2(g)
O2(g)![]() NO2(g)+
NO2(g)+![]() H2O(g) △H=-299.6kJ·mol-1
H2O(g) △H=-299.6kJ·mol-1
②H2(g)+![]() O2(g)=H2O(g) △H=-241.8kJ·mol-1
O2(g)=H2O(g) △H=-241.8kJ·mol-1
③N2(g)+2O2(g)=2NO2(g) △H=+33.9kJ·mol-1
由上述反应,可求出N2(g)+3H2(g)![]() 2NH3(g)的△H=___。
2NH3(g)的△H=___。
(2)对于反应①,在恒温恒容(H2O为气态)的容器中,下列选项表明反应已达到平衡的是___。
A.混合气体的平均摩尔质量不变
B.混合气体的密度不变
C.气体的颜色不再变化
D.体系内压强不再变化
E.每消耗1molNH3的同时生成1molNO2
(3)已知:N2(g)+3H2(g)![]() 2NH3(g)反应的熵变△S=-0.081kJ·mol-1·K-1,则298K时,该反应___(填“能”或“不能”)自发进行。
2NH3(g)反应的熵变△S=-0.081kJ·mol-1·K-1,则298K时,该反应___(填“能”或“不能”)自发进行。
(4)如图为673K温度下,某合成氨塔里各气体组分压强变化图。
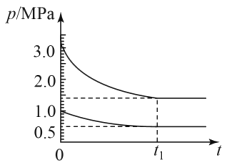
①t1平衡时,氨气的体积分数为___%(保留位小数)。
②在图中画出氨气组分压强变化图___。
③该温度下N2(g)+3H2(g)![]() 2NH3(g)反应的压力平衡常数Kp=___(MPa)-2(保留1位小数,Kp为以气体分压表示反应的平衡常数)
2NH3(g)反应的压力平衡常数Kp=___(MPa)-2(保留1位小数,Kp为以气体分压表示反应的平衡常数)
【答案】-92.3kJ·mol-1 ACD 能 33.3% 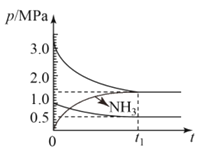 0.6
0.6
【解析】
(1)将目标方程式N2(g)+3H2(g)![]() 2NH3(g)和已知方程式对照可得出:③+3×②-2×①=目标方程式;
2NH3(g)和已知方程式对照可得出:③+3×②-2×①=目标方程式;
(2)平衡的标志:一是同一物质表示的正反应速率和逆反应速率相等,二是体系中各组分的含量不变;
(3)△G=△H-T△s<0时,反应能自发进行;
(4)在恒温恒容条件下,气体的压强之比与物质的量成正比;从图上看,一条曲线分压减小值=(3.0-1.5)MPa=1.5MPa,另一条曲线分压减小值=(1.0-0.5)MPa=0.5MPa,这两条曲线应分别代表氢气、氮气的分压变化曲线,氨气应从0增加到1.0MPa。
(1)已知:①NH3(g)+![]() O2(g)
O2(g)![]() NO2(g)+
NO2(g)+![]() H2O(g) △H=-299.6kJ·mol-1,②H2(g)+
H2O(g) △H=-299.6kJ·mol-1,②H2(g)+![]() O2(g)=H2O(g) △H=-241.8kJ·mol-1,③N2(g)+2O2(g)=2NO2(g) △H=+33.9kJ·mol-1,③+3×②-2×①=目标方程式,故△H=(+33.9kJ·mol-1)+3×(-241.8kJ·mol-1)-2×(-299.6kJ·mol-1)=-92.3kJ·mol-1;
O2(g)=H2O(g) △H=-241.8kJ·mol-1,③N2(g)+2O2(g)=2NO2(g) △H=+33.9kJ·mol-1,③+3×②-2×①=目标方程式,故△H=(+33.9kJ·mol-1)+3×(-241.8kJ·mol-1)-2×(-299.6kJ·mol-1)=-92.3kJ·mol-1;
(2)恒温恒容下发生:NH3(g)+![]() O2(g)
O2(g) ![]() NO2(g)+
NO2(g)+![]() H2O(g);
H2O(g);
A.正反应是气体总物质的量n减小,混合气体总质量自始至终不变的反应,由![]() 可知,当混合气体的平均摩尔质量不变时,说明混合气体的总物质的量n不变,反应已达平衡,故A正确;
可知,当混合气体的平均摩尔质量不变时,说明混合气体的总物质的量n不变,反应已达平衡,故A正确;
B.该反应的气体总质量m不变,总体积V不变,由![]() 可知,无论反应是否平衡,混合气体的密度都不变,即混合气体的密度不变,不能说明反应是否已平衡,故B错误;
可知,无论反应是否平衡,混合气体的密度都不变,即混合气体的密度不变,不能说明反应是否已平衡,故B错误;
C.该反应中的NO2为红棕色,由于恒容,导致该反应的正反应是气体颜色加深的反应,若反应未平衡,则气体颜色会一直加深,现气体的颜色不再变化,说明反应已达平衡,故C正确;
D.恒容时,该反应的正反应体系总压强减小的反应,当体系内压强不再变化,说明反应已达平衡,故D正确;
E.由方程式可知,无论是否平衡,每消耗1molNH3的同时一定生成1molNO2,即消耗1molNH3的同时生成1molNO2不能说明反应是否平衡,故E错误;
故答案为:ACD;
(3)△S=-0.081kJ·mol-1·K-1,T= 298K,△H=-92.3kJ·mol-1,则△G=△H-T△s =(-92.3kJ·mol-1)-298K×(-0.081kJ·mol-1·K-1)=-68.162kJ·mol-1<0,该反应能自发进行;
(4)在恒温恒容条件下,气体的压强之比与物质的量成正比;从图上看,t1平衡时,一条曲线分压减小值=(3.0-1.5)MPa=1.5MPa,另一条曲线分压减小值=(1.0-0.5)MPa=0.5MPa,这两条曲线应分别代表氢气、氮气的分压变化曲线,氨气应从0增加到1.0MPa。
①t1平衡时,氢气的平衡分压为1.5MPa,氮气的平衡分压为0.5MPa,氨气的平衡分压为1.0MPa,已知恒温恒容条件下,气体的压强之比与物质的量成正比,则氨气的体积分数为![]() ×100%≈33.3%;
×100%≈33.3%;
②在0~t1达到平衡过程中氨气应从0增加到1.0MPa,则氨气组分压强变化图为;
③t1平衡时,氢气的平衡分压为1.5MPa,氮气的平衡分压为0.5MPa,氨气的平衡分压为1.0MPa,该温度下N2(g)+3H2(g)![]() 2NH3(g)反应的压力平衡常数Kp=
2NH3(g)反应的压力平衡常数Kp=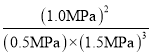 ≈0.6。
≈0.6。

 阅读快车系列答案
阅读快车系列答案【题目】某同学在实验室中进行如下实验:
编号 | Ⅰ | Ⅱ | Ⅲ |
实验 |
|
|
|
现象 | 没有明显变化,溶液仍为无色 | 有沉淀生成,溶液为蓝色 | 有无色气泡产生 |
以下结论不正确的是
A.Ⅰ中无明显变化,说明两溶液不反应B.Ⅱ中的白色沉淀为BaSO4
C.Ⅲ中的化学方程式为2HCl+Zn=ZnCl2+H2↑D.Ⅲ中发生的反应是氧化还原反应