题目内容
【题目】实验室可用KMnO4和浓盐酸反应制取氯气。
KMnO4+HCl(浓)=KCl+MnCl2+Cl2↑+H2O(未配平)
(1)配平化学方程式,并用单线桥标出电子转移的方向和数目。
(2)将上述配平的化学方程式改写为离子方程式 。
(3)浓盐酸在反应中显示出来的性质是________________
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(4)若产生0.5molCl2,则被氧化的HCl mol,转移的电子的数目约为___________。
(5)一定条件下,KMnO4还可以氧化其他还原性物质。
MnO4-+C2O42-+ = Mn2+ +CO2↑+
完成上述离子方程式,此反应中,发生氧化反应的物质是 ;若转移1mol电子,生成标准状况下CO2 L。
【答案】(1)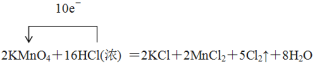
(2)2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O
(3)②(4)1;6.02×1023
(5)16H+;8H2O;C2O42-;22.4
【解析】
试题分析:(1)反应中Mn元素的化合价从+7价降低到+2价,得到5个电子,盐酸中氯元素的化合价从-1价升高到0价,失去1个电子,所以配平后的方程式为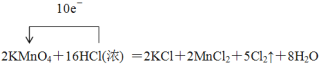 。
。
(2)该反应的离子方程式为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(3)反应中氯元素的化合价升高,盐酸贝氧化,作还原剂。另外还有氯化锰生成,因此还起到酸性的作用,答案选②;
(4)若产生0.5molCl2,则根据氯原子守恒可知被氧化的HCl是1mol,转移的电子的数目约为6.02×1023。
(5)反应中Mn元素的化合价从+7价降低到+2价,得到5个电子,草酸中碳元素的化合价从+3价升高到+4价,失去1个电子,所以配平后的方程式为2MnO4-+5C2O42-+16H+=2Mn2+ +10CO2↑+8H2O;此反应中,发生氧化反应的物质是C2O42-;若转移1mol电子,生成标准状况下CO2的体积为1mol×22.4L/mol=22.4L。

 名校课堂系列答案
名校课堂系列答案