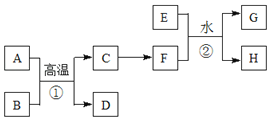
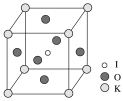
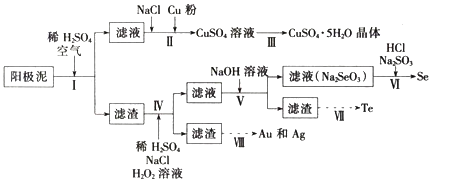
【题目】工业上可以从电解铜的阳极泥中提取很多重要物质,其工艺流程如下:
已知:①阳极泥的主要化学成分,如表所示:
主要成分 | Cu Ag Au Se Te |
百分含量/% | 23.4 12.1 0.9 6.7 3.1 |
②温度和硫酸浓度对阳极泥中各组分浸出率的影响,如表所示:
固定浸出温度 | 固定H2SO4浓度 | |||
H2SO4浓度 / mol·L-1 | 浸出率/% | 浸出温度/℃ | 浸出率/% | |
Cu Ag Au Se Te | Cu Ag Au Se Te | |||
4 | 95.1 4.67 <0.2 0.83 8.93 | 30 | 87.1 4.58 <0.2 0.08 6.83 | |
3 | 94.5 4.65 <0.2 0.28 6.90 | 40 | 94.5 4.65 <0.2 0.28 6.90 | |
2 | 78.1 2.65 <0.2 0.05 2.85 | 50 | 96.1 5.90 <0.2 0.64 8.73 |
(1)步骤I的主要目的为浸出铜,发生的主要反应的化学方程式为__________;分析表2数据,可知步骤I最适合的条件为______________。
(2)步骤II中,加入Cu粉的目的是除去滤液中含碲的离子,加入NaCl的目的为________。
(3)步骤III的操作方法为___________。
(4)步骤IV中,反应温度为75℃。加入H2O2溶液作用为______________;此过程中H2O2溶液的添加量要远远高于理论值,原因为_____________。
(5)步骤VI中所发生反应的化学方程式为_______。
(6)步骤VII中,碱性环境下电解Na2TeO3溶液可得Te实现,阴极的电极反应式为_____。
【题目】实验室用密度为1.18g/ml,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液
实际应量取盐酸体积/ml | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
______________ | ______________ | ______________ |
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)______________;
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是_________________________________,溶液注入容量瓶前需恢复到室温,这是因为______________________________________;
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作_______________;若加蒸馏水时不慎超过了刻度_______________;若定容时俯视刻度线___________________。
(5)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度_______________;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面_____________________。