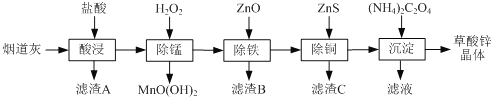
题目内容
【题目】工业上可以从电解铜的阳极泥中提取很多重要物质,其工艺流程如下:
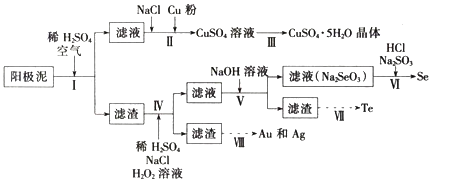
已知:①阳极泥的主要化学成分,如表所示:
主要成分 | Cu Ag Au Se Te |
百分含量/% | 23.4 12.1 0.9 6.7 3.1 |
②温度和硫酸浓度对阳极泥中各组分浸出率的影响,如表所示:
固定浸出温度 | 固定H2SO4浓度 | |||
H2SO4浓度 / mol·L-1 | 浸出率/% | 浸出温度/℃ | 浸出率/% | |
Cu Ag Au Se Te | Cu Ag Au Se Te | |||
4 | 95.1 4.67 <0.2 0.83 8.93 | 30 | 87.1 4.58 <0.2 0.08 6.83 | |
3 | 94.5 4.65 <0.2 0.28 6.90 | 40 | 94.5 4.65 <0.2 0.28 6.90 | |
2 | 78.1 2.65 <0.2 0.05 2.85 | 50 | 96.1 5.90 <0.2 0.64 8.73 |
(1)步骤I的主要目的为浸出铜,发生的主要反应的化学方程式为__________;分析表2数据,可知步骤I最适合的条件为______________。
(2)步骤II中,加入Cu粉的目的是除去滤液中含碲的离子,加入NaCl的目的为________。
(3)步骤III的操作方法为___________。
(4)步骤IV中,反应温度为75℃。加入H2O2溶液作用为______________;此过程中H2O2溶液的添加量要远远高于理论值,原因为_____________。
(5)步骤VI中所发生反应的化学方程式为_______。
(6)步骤VII中,碱性环境下电解Na2TeO3溶液可得Te实现,阴极的电极反应式为_____。
【答案】2Cu+O2+2H2SO4=2CuSO4+2H2O 硫酸浓度3 mol·L-1、浸出温度40℃ 除去滤液中的Ag+ 加热浓缩(蒸发)、冷却结晶、过滤 氧化滤渣中的硒和碲,使其进入溶液中 增加硒和碲的浸出率、H2O2会有部分分解 Na2SeO3+2Na2SO3+2HCl=Se+2Na2SO4+2NaCl+H2O TeO32—+4e-+3H2O=Te+6OH-
【解析】
(1)根据阳极泥的成分和流程图,及题目要求,主要反应是铜与硫酸及空气中氧气的反应,配平方程式即可;根据题目中所给表格②中数据分析,综合考虑浸出率和经济性等原则得出结论;
(2)步骤Ⅱ中,加入NaCl的目的显然是使Ag+转化为氯化银沉淀而除去;
(3)使结晶水合物从溶液中结晶析出的步骤是:蒸发浓缩、冷却结晶、过滤等;
(4)步骤Ⅳ中,反应温度为75℃.加入H2O2溶液的作用为氧化滤渣中的硒和碲,使其进入溶液中;此过程中H2O2溶液的添加量要远远高于理论值,原因是:从速率及平衡角度考虑,可增加硒和碲的浸出率,H2O2会有部分分解,有损失;
(5)根据流程图中的反应物和生成物,配平方程式即可;
(6)根据反应物Na2TeO3和生成物Te,结合碱性条件,阴极应发生还原反应,根据守恒即可写出其电极反应式。
(1)根据阳极泥的成分和流程图及题目要求,主要反应是铜与硫酸及空气中氧气的反应,反应的方程式为2Cu+O2+2H2SO4=2CuSO4+2H2O;根据题目中所给表格②中数据分析,可知当硫酸浓度为2 molL-1、浸出温度30℃时浸出率太低,硫酸浓度为3 molL-1、浸出温度40℃时浸出率已较高,再增大浓度和升温对浸出率影响不大,但会浪费试剂和能源;故可知步骤I最适合的条件为 :硫酸浓度3 molL-1、浸出温度40℃;
(2)步骤Ⅱ中,加入NaCl的目的显然是使Ag+转化为氯化银沉淀而除去;
(3)使结晶水合物从溶液中结晶析出的步骤是:蒸发浓缩、冷却结晶、过滤等;
(4)硒和碲不溶于水,步骤Ⅳ中,反应温度为75℃.加入H2O2溶液的作用为氧化滤渣中的硒和碲,使其进入溶液中;此过程中H2O2溶液的添加量要远远高于理论值,原因是:从速率及平衡角度考虑,可增加硒和碲的浸出率;H2O2会有部分分解;
(5)根据流程图中的反应物和生成物,根据得失电子守恒、原子守恒,反应的方程式为Na2SeO3+2Na2SO3+2HCl=Se+2Na2SO4+2NaCl+H2O;
(6)根据反应物Na2TeO3和生成物Te,结合碱性条件,阴极应发生还原反应,根据守恒即可写出其电极反应式TeO32-+4e-+3H2O=Te+6OH-。

【题目】Ⅰ.在测定空气里氧气含量的实验中,小明采用了如图所用的装置:
装置一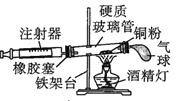 装置二
装置二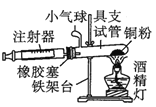
在由注射器和硬质玻璃管组成的密闭系统中留有40mL空气,给装有铜粉的玻璃管加热,观察密闭系统内空气体积变化。
(1)在实验加热过程中,缓慢推动注射器活塞的目的是__________。
(2)装置一比装置二更______(填“合理”或“不合理”),理由是_________。
(3)小明测得的实验结果如下:
反应前注射器内气体总体积 | 反应后注射器内气体总体积 |
15mL | 10mL |
由此数据可推算出他测定的氧气的体积分数________21%(填“>”“<”或“=”),造成该实验出现误差的原因可能是____________(填序号)。
①推动注射器活塞速度太快 ②未冷却至室温就读数 ③加入铜粉量太少
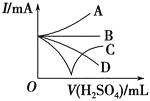
Ⅱ.H2O2分解速率受多种因素影响。实验测得70 ℃时不同条件下H2O2浓度随时间的变化如图所示。
图甲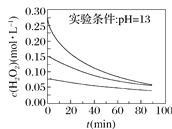 图乙
图乙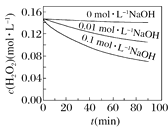
(4)根据上图,将不同条件对速率的影响情况补充完整:图甲表明,____________,H2O2分解速率越快;图乙表明,_________,H2O2分解速率越快。