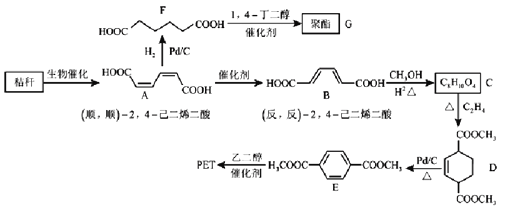
题目内容
【题目】常温下,在27.5g水中溶解12.5g CuSO4·5H2O,恰好达到饱和,该溶液密度为1.21g /cm3,求:
① 该溶液中阴阳离子的总物质的量
② 该溶液中CuSO4的物质的量浓度
③ 取出20.0 ml该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是多少毫升?
【答案】(1)0.05 mol
(2)33.1 m L
(3)1.51 mol/L
(4)30.2
【解析】
考查物质的量的有关计算。
(1)CuSO4·5H2O的摩尔质量是250g/mol
所以12.5g CuSO4·5H2O的物质的量是
12.5g÷250g/mol=0.05mol
溶液中电离出的阴阳离子分别是Cu2+和SO42-
所以该溶液中溶质电离出的阴阳离子的总物质的量是0.05mol+0.05mol=0.1mol
(2)溶液的质量是27.5g+12.5g=40g
所以溶液的体积是40g÷1.21g/ml=0.033L
所以物质的量浓度是0.05mol÷0.33L=1.51mol/L
(3)在稀释过程中溶质是不变的
所以稀释后的溶液的体积是![]() 。
。

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案
相关题目