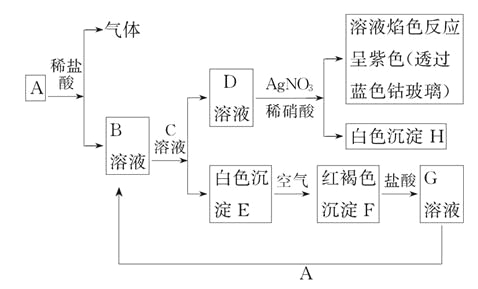
题目内容
【题目】新旧动能转换工程之一是新能源新材料的挖掘和应用。乙二醇是重要的化工原料, 煤基合成气(CO、H2)间接制乙二醇具有转化率高、回收率高等优点,是我国一项拥有自主知识产权的世界首创技术,制备过程如下:
反应 I:4NO(g)+4CH3OH(g)+O2(g)![]() 4CH3ONO(g)+2H2O(g) △H1 =akJ·mol-1
4CH3ONO(g)+2H2O(g) △H1 =akJ·mol-1
反应 II:2CO(g)+2CH3ONO(g)![]() CH3OOCCOOCH3(l)+2NO(g) △H2=b kJ·mol-1
CH3OOCCOOCH3(l)+2NO(g) △H2=b kJ·mol-1
反应 III:CH3OOCCOOCH3(1)+4H2(g)![]() HOCH2CH2OH(1)+2CH3OH(g) △H3=c kJ·mol-1
HOCH2CH2OH(1)+2CH3OH(g) △H3=c kJ·mol-1
(1)请写出煤基合成气[n(CO):n(H2)= 1:2]与氧气间接合成乙二醇的总热化学方程式:__,该反应在较低温条件下能自发进行,则ΔH___0(填“>”、“<”或“=”)。
(2)一定温度下,在2L的密闭容器中投入物质的量均为0.4mol的CO和CH3ONO发生反应II,10min达到平衡时CO的体积分数与NO的体积分数相等。
①下列选项能判断反应已达到化学平衡状态的是____。
a.CO的质量不再变化
b.混合气体的密度不再变化
c.单位时间内生成CO和NO的物质的量相等
d.CO和CH3ONO的浓度比不再变化
②若此时向容器中再通入0.4molNO,一段时间后,达到新平衡时NO的体积分数与原平衡时相比__(填“增大”“相等”“减小”或“不能确定”)。
③若该反应△H<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是____(填字母)。
a.  b.
b. 
c.  d.
d. 
【答案】4H2(g)+2CO(g)+![]() O2(g)
O2(g)![]() HOCH2CH2OH(l)+H2O(g) △H3=(
HOCH2CH2OH(l)+H2O(g) △H3=(![]() a+b+c)kJ·mol-1 < abc 增大 b
a+b+c)kJ·mol-1 < abc 增大 b
【解析】
(1)根据盖斯定律,将已知的热化学方程式叠加,可得待求的反应的热好方程式。根据反应自发进行的判断依据分析反应热ΔH与0的大小;
(2)①根据可逆反应平衡状态的特征判断;
②根据勒夏特列原理分析,改变平衡移动的条件,平衡向减弱这个因素的方向移动,但不可能完全消除;
③根据影响平衡的移动因素并结合图象分析判断。
(1)已知反应 I:4NO(g)+4CH3OH(g)+O2(g)![]() 4CH3ONO(g)+2H2O(g) △H1 =akJ·mol-1、反应II:2CO(g)+2CH3ONO(g)
4CH3ONO(g)+2H2O(g) △H1 =akJ·mol-1、反应II:2CO(g)+2CH3ONO(g)![]() CH3OOCCOOCH3(l)+2NO(g) △H2=b kJ·mol-1、反应III:CH3OOCCOOCH3(1)+4H2(g)
CH3OOCCOOCH3(l)+2NO(g) △H2=b kJ·mol-1、反应III:CH3OOCCOOCH3(1)+4H2(g)![]() HOCH2CH2OH(1)+2CH3OH(g) △H3=ckJ·mol-1,根据盖斯定律,由I×+Ⅱ+Ⅲ得反应4H2(g)+2CO(g)+
HOCH2CH2OH(1)+2CH3OH(g) △H3=ckJ·mol-1,根据盖斯定律,由I×+Ⅱ+Ⅲ得反应4H2(g)+2CO(g)+![]() O2(g)
O2(g)![]() HOCH2CH2OH(l)+H2O(g) △H3=(
HOCH2CH2OH(l)+H2O(g) △H3=(![]() a+b+c)kJ·mol-1,则△H3=(
a+b+c)kJ·mol-1,则△H3=(![]() a+b+c)kJ·mol-1;该反应为熵减的反应,即△S<0,已知该反应在较低温条件下能自发进行,要使△G=△H-T△S<0,必须△H<0;
a+b+c)kJ·mol-1;该反应为熵减的反应,即△S<0,已知该反应在较低温条件下能自发进行,要使△G=△H-T△S<0,必须△H<0;
(2)①a.CO的质量不再变化,说明反应已达到平衡状态,a符合题意;
b.该反应在恒容条件下进行,且参与物质不完全为气体,气体的密度为变量,当混合气体的密度不再变化,说明反应已达平衡状态,b符合题意;
c.CO和NO一种是反应物,一种是生成物,若单位时间内生成CO和NO的物质的量相等,说明正逆反应速率相等,反应达到平衡状态,c符合题意;
d.CO和CH3ONO的投料相等且在反应中计量数相等,因此两者的浓度比始终不变,不能据此作为平衡状态的判断依据,d不符合题意;
故合理选项为abc;
②若此时向容器中再通入0.4 mol NO,NO的体积分数增大,平衡逆向移动,但平衡移动的趋势是微弱的,根据勒夏特列原理可知,重新平衡时 NO的体积分数与原平衡时相比增大;
③a.该反应为气体计量数减小的放热反应,升高温度,平衡逆向移动,生成物浓度减小,反应物浓度增大,平衡常数减小,a错误;
b.平衡常数只与温度有关,与反应的物质的物质的量及浓度无关,故NO的物质的量变化,K值保持不变,b正确;
c.该反应为放热反应,升高温度平衡逆向移动,NO的体积分数减小,c错误;
d.该反应为气体体积缩小的反应,增大压强,平衡正向移动,CO的转化率增大,d错误;
故合理选项是b。