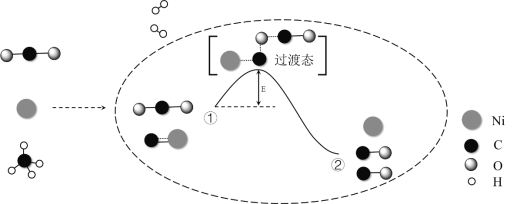
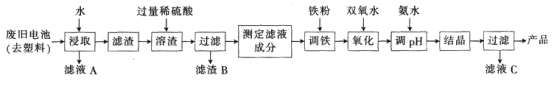
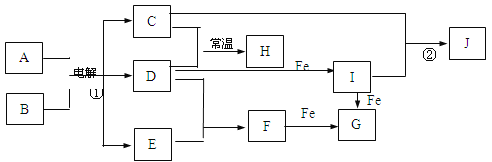
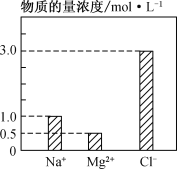
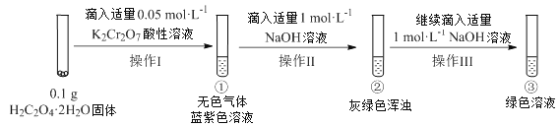
0 197659 197667 197673 197677 197683 197685 197689 197695 197697 197703 197709 197713 197715 197719 197725 197727 197733 197737 197739 197743 197745 197749 197751 197753 197754 197755 197757 197758 197759 197761 197763 197767 197769 197773 197775 197779 197785 197787 197793 197797 197799 197803 197809 197815 197817 197823 197827 197829 197835 197839 197845 197853 203614