题目内容
【题目】将等物质的量的A和B,混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),5min后测得c(D)=0.5mol/L,c(A):c(B)=1:2,C的反应速率是 0.15 mol/(Lmin)。
xC(g)+2D(g),5min后测得c(D)=0.5mol/L,c(A):c(B)=1:2,C的反应速率是 0.15 mol/(Lmin)。
(1)B的反应速率v(B)=_____X=___
(2)A在5min末的浓度是___
(3)此时容器内的压强与开始时之比为:____。
(4)二氯化硫(S2Cl2)是一种琥珀色液体,是合成硫化染料的重要原料。写出它的电子式______;
(5)硒的原子序数为34,硒的单质及其化合物用途非常广泛。
a.硒在元素周期表中的位置是___。Se2Cl2常用作分析试剂,其结构式为___。
b.硒化铟是一种可应用于未来超算设备的新型半导体材料。已知铟(In)与铝同族且比铝多两个电子层。下列说法正确的是___(填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
【答案】0.05mol/(L·min) 3 0.5mol/L 11:10 ![]() 第四周期第ⅥA族 Cl-Se-Se-Cl AB
第四周期第ⅥA族 Cl-Se-Se-Cl AB
【解析】
利用三段式法解答,设A、B的物质的量为nmol,D的浓度为0.5mol/L,则D的物质的量为1mol,则:
3A(g)+B(g)=xC(g)+2D(g)
开始(mol) n n 0 0
反应(mol) 1.5 0.5 0.5x 1
5min(mol) n-1.5 n-0.5 0.5x 1
即c(A):c(B)=n(A):n(B)=(n-1.5):( n-0.5)=1:2,解得n=2.5mol;
(1)根据D的浓度求出D的反应速率,B、C、D反应速率之比即为计量数之比,求出X;
(2)根据A的物质的量求出A的浓度;
(3)根据容器内的压强之比等于物质的量之比计算容器内的压强与反应开始时的压强之比;
(4)该分子中每个S原子形成2个共用电子对、每个Cl原子共用一个电子对;
(5)a.硒的原子序数为34,是硫的同主族元素,位于S的下方;Se2Cl2中存在Se-Se键及Se-Cl键;
b.铟(In)与铝同族且比铝多两个电子层,位于第五周期IIIA族,结合元素周期律分析。
利用三段式法解答,设A、B的物质的量为nmol,D的浓度为0.5mol/L,则D的物质的量为1mol,则:
3A(g)+B(g)=xC(g)+2D(g)
开始(mol) n n 0 0
反应(mol) 1.5 0.5 0.5x 1
5min(mol) n-1.5 n-0.5 0.5x 1
即c(A):c(B)=n(A):n(B)=(n-1.5):( n-0.5)=1:2,解得n=2.5mol;
(1)D的反应速率v(D)=0.5molL-1÷5min=0.1molL-1min-1,v(B):v(C):v(D)=1:x:2=0.05:0.15:0.1,解得:v(B)=0.05mol/(L·min),x=3;
(2)5min末A的浓度=![]() =0.5mol/L;
=0.5mol/L;
(3)5min时容器内气体的总物质的量为(2.5-1.5+2.5-0.5+0.5×3+1)mol=5.5mol,所以5min时容器内的压强与反应开始时的压强之比=5.5mol:2.5mol×2=11:10;
(4)该分子中每个S原子形成2个共用电子对、每个Cl原子共用1个电子对;各原子要达到8电子稳定结构,则S原子在中间,Cl原子在两端,其电子式为![]() ;
;
(5)a.硒的原子序数为34,是硫的同主族元素,位于S的下方,则位于周期表第四周期ⅥA族,与S2Cl2类似,Se2Cl2的电子式为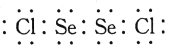 ,则结构式为Cl-Se-Se-Cl;
,则结构式为Cl-Se-Se-Cl;
(2)铟(In)与铝同族且比铝多两个电子层,位于第五周期IIIA族;
A.电子层越多,原子半径越大,则原子半径:In>Se,故A正确;
B.元素周期表中左下方元素的金属性强,则In的金属性比Se强,故B正确;
C.同主族从上到下金属性增强,则In的金属性比Al强,故C错误;
D.类似于Al2O3,则硒化铟的化学式为In2Se3,故D错误;
故答案为AB。