��Ŀ����
����Ŀ��Fe�����岻��ȱ�ٵ���Ԫ�أ����뺬��������ɲ�������������������(FeSO4��7H2O)��ҽҩ������Ѫ����ij����С��ⶨ�ò�Ѫ������Ԫ�صĺ�����ʵ�鲽�����£���
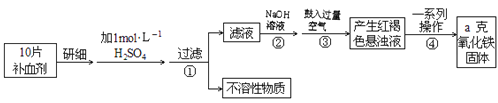
��ش��������⣺
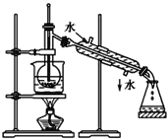
��1��������м�������NaOH��������Ҫ��Ӧ�����ӷ���ʽΪ______________��������з�Ӧ�Ļ�ѧ����ʽΪ_____________________��
��2���������һϵ�д����IJ������裺___________��ϴ�ӡ�___________����ȴ��������
��3��ʵ��������98%Ũ����(�ܶ�1.84g/mL)����1mol/L��ϡ����480mL������ʱ�õ��IJ�����������Ͳ���ձ�����ͷ�ιܡ����������___________��������Ͳ��ȡŨ����________mL��
��4����ʵ������ģ���ÿƬ��Ѫ������Ԫ�ص�����___________g(�ú�a�Ĵ���ʽ��ʾ)
���𰸡�Fe2++2OH-=Fe(OH)2�� 4Fe(OH)2+O2+2H2O=4Fe(OH)3 ���� ���� 500mL����ƿ 27.2mL 0.07a
��������
��1��������м�������NaOH�������������������Ʒ�Ӧ���������������������������������е�������������������Ҫ��Ӧ�����ӷ���ʽΪFe2++2OH-=Fe(OH)2����4Fe(OH)2+O2+2H2O=4Fe(OH)3���ʴ�ΪFe2++2OH-=Fe(OH)2����4Fe(OH)2+O2+2H2O=4Fe(OH)3��
��2���������һϵ�д�������������������Һ����ת��Ϊ����������Ҫ���ˡ�ϴ�ӵ�����������Ȼ��������������������ȴ��������������������ʴ�Ϊ���ˣ����գ�
��3������480mL 1mol/L��ϡ���ᣬ����ʱ��Ҫ�������в������ձ�����ͷ�ιܡ�500mL����ƿ����Ͳ��Ũ��������ʵ���Ũ��=![]() =
=![]() =18.4mol/L������480mL 1mol/L��ϡ���ᣬ������Ͳ��ȡŨ��������=
=18.4mol/L������480mL 1mol/L��ϡ���ᣬ������Ͳ��ȡŨ��������=![]() =0.0272L=27.2mL���ʴ�Ϊ500mL����ƿ��27.2mL��
=0.0272L=27.2mL���ʴ�Ϊ500mL����ƿ��27.2mL��
��4��ag����������Ԫ�ص�������Ϊ10Ƭ��Ѫ������������������ÿƬ��Ѫ������Ԫ�ص�����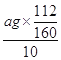 =0.07ag���ʴ�Ϊ0.07a��
=0.07ag���ʴ�Ϊ0.07a��