题目内容
【题目】实验小组进行如下实验:
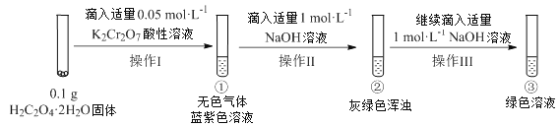
已知:Cr2(SO4)3稀溶液为蓝紫色;Cr(OH)3为灰绿色固体,难溶于水。
下列关于该实验的结论或叙述不正确的是
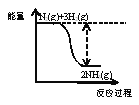
A. ①中生成蓝紫色溶液说明K2Cr2O7在反应中表现了氧化性
B. 若继续向③中加入稀硫酸,溶液有可能重新变成蓝紫色
C. 将①与③溶液等体积混合会产生灰绿色浑浊,该现象与Cr3+的水解平衡移动有关
D. 操作I中产生的无色气体是CO
【答案】D
【解析】
往H2C2O4·2H2O固体中滴入适量的K2Cr2O7酸性溶液,发生反应的化学方程式为:2K2Cr2O7+6H2C2O4+8H2SO4=2K2SO4+2Cr2(SO4)3+12CO2↑+14H2O,生成Cr2(SO4)3为蓝紫色溶液,无色气体为CO2,滴入适量的NaOH溶液,生成Cr(OH)3为灰绿色固体,可以看到
灰绿色浑浊,继续滴加NaOH溶液,可以看到灰绿色浑浊溶解,生成绿色的CrO2-,据此答题。
A.①中发生反应的化学方程式为:2K2Cr2O7+6H2C2O4+8H2SO4=2K2SO4+2Cr2(SO4)3+12CO2↑+14H2O,K2Cr2O7中Cr元素的化合价由+6价→+3价,化合价降低,作氧化剂,表现为氧化性,故A正确;
B.向蓝紫色Cr2(SO4)3溶液中,加入NaOH溶液至析出灰绿色沉淀,此时,溶液中存在着如下平衡Cr3+(蓝紫色)+3OH-Cr(OH)3(灰绿色)CrO2-(绿色)+H++H2O,加入稀硫酸,会增大氢离子浓度,平衡向逆反应方向移动,溶液显蓝紫色,故B正确;
C.①溶液中含有Cr3+,③溶液中含有CrO2-,Cr3+与CrO2-双水解,反应的离子方程式为:Cr3++3CrO2- +6H2O=4Cr(OH)3↓,会产生灰绿色浑浊,故C正确;
D.由反应方程式2K2Cr2O7+6H2C2O4+8H2SO4=2K2SO4+2Cr2(SO4)3+12CO2↑+14H2O可知,操作I中产生的无色气体是CO2,故D错误。
故选D。

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案