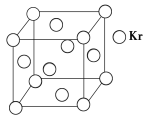
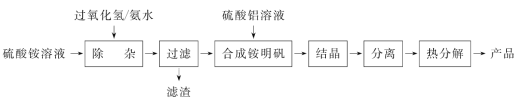
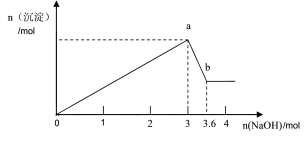
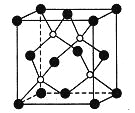
0 197365 197373 197379 197383 197389 197391 197395 197401 197403 197409 197415 197419 197421 197425 197431 197433 197439 197443 197445 197449 197451 197455 197457 197459 197460 197461 197463 197464 197465 197467 197469 197473 197475 197479 197481 197485 197491 197493 197499 197503 197505 197509 197515 197521 197523 197529 197533 197535 197541 197545 197551 197559 203614