��Ŀ����
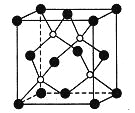
����Ŀ���ߴ���������(Al2O3)����;�ܹ㡣ʵ������(NH4)2SO4��H2O2����ˮ��Al2(SO4)3Ϊԭ�ϣ�ͨ�����¹����Ʊ�Al2O3��
��1���������������Ǽ���H2O2���ð�ˮ������Һ��pHԼΪ3���Գ�ȥ�������Һ��������Fe2����
�� ������Һ��Fe2����H2O2��Ӧ�����ӷ���ʽΪ________________________________��
�� �����Ļ�ѧʽΪ__________��
�� �������������������Ƿ������ʵ�鷽����____________________________________��
��2�� ����Al2(SO4)3��Һʱ�����������ữ��Ŀ����_______________________________��
��3�� �����[NH4Al(SO4)2��12H2O]ǿ�ȷֽ�IJ���ΪAl2O3��NH3��N2��SO3��SO2��H2O���÷�Ӧ���������뻹ԭ��������ʵ���֮��Ϊ__________��
��4��ǿ�ȷֽ����þƾ���ƣ�������õ��Ĺ�������������______(����)��
a �ձ� b ���� c ������ d ������
���𰸡�2Fe2����H2O2��2H��==2Fe3����2H2O Fe(OH)3 ȡ�������˺���Һ���Թ��У����뼸��KSCN��Һ������Һδ���ɫ��˵�������Ѿ����� ����Al3��ˮ�� 1��3 bcd
��������
��1�����������Ӿ��л�ԭ�ԣ�˫��ˮ����ǿ�����ԣ���������Һ�У��������ӱ��������������ӣ�
��H2O2��Һ����ǿ�����ԣ��������������������������ӣ��������ڰ�ˮ���ڵ����������������������ɫ������
���ɹ������̿�֪������������⽫��Һ��Fe2+����ΪFe3+�����백ˮ������ҺpHֵ��Fe3+ʹת��ΪFe(OH)3�����˺����Һ�п��ܺ���Fe3+��ȡ������Һ���Թ��У��Ӽ���KSCN��Һ������Һ�����ɫ���������ѳ�����
��2����������������Һ���ܹ�����ˮ�������������������Լ��������ữ�������������ӵ�ˮ�⣻
��3��(NH4)2SO4�ڸ����·ֽⷴӦ�Ļ�ѧ����ʽΪ��3(NH4)2SO4![]() 3SO2����N2����4NH3����6H2O��N2���������SO42��SO2����Ԫ�صĻ��ϼ���+6����+4�ۣ�����SO2�ǻ�ԭ����ɷ�Ӧ����ʽ�ļ���ϵ����֪����������ͻ�ԭ��������ʵ���֮��Ϊ1:3��
3SO2����N2����4NH3����6H2O��N2���������SO42��SO2����Ԫ�صĻ��ϼ���+6����+4�ۣ�����SO2�ǻ�ԭ����ɷ�Ӧ����ʽ�ļ���ϵ����֪����������ͻ�ԭ��������ʵ���֮��Ϊ1:3��
��4������Ӧ�������н��У��������������ǡ�����������ʹ�ã����д��������մ����ģ������ǹ��������ģ���������Ҫ�ɷ��ǹ����ƣ����ڹ������ʵ�������bcd��
��1�����������Ӿ��л�ԭ�ԣ�˫��ˮ����ǿ�����ԣ���������Һ�У��������ӱ��������������ӣ��˷�Ӧ�����ӷ�Ӧ����ʽΪ��2Fe2++H2O2+2H+=2Fe3++2H2O����С���Ϊ��2Fe2++H2O2+2H+=2Fe3++2H2O��
��H2O2��Һ����ǿ�����ԣ��������������������������ӣ��������ڰ�ˮ���ڵ����������������������ɫ��������Ӧ�����ӷ���ʽ��2Fe2++H2O2+4NH3H2O=2Fe(OH)3��+4NH4+�����˲��������õ�������Ҫ�ɷ�������������ѧʽΪFe(OH)3����С���Ϊ��Fe(OH)3��
���ɹ������̿�֪������������⽫��Һ��Fe2+����ΪFe3+�����백ˮ������ҺpHֵ��Fe3+ʹת��ΪFe(OH)3�����˺����Һ�п��ܺ���Fe3+��ȡ������Һ���Թ��У��Ӽ���KSCN��Һ������Һ�����ɫ���������ѳ�������С���Ϊ��ȡ�������˺���Һ���Թ��У����뼸��KSCN��Һ������Һδ���ɫ��˵�������Ѿ�������
��2����������������Һ���ܹ�����ˮ�������������������Լ��������ữ�������������ӵ�ˮ�⡣��С���Ϊ������Al3��ˮ�⡣
��3��(NH4)2SO4�ڸ����·ֽⷴӦ�Ļ�ѧ����ʽΪ��3(NH4)2SO4![]() 3SO2����N2����4NH3����6H2O��N2���������SO42��SO2����Ԫ�صĻ��ϼ���+6����+4�ۣ�����SO2�ǻ�ԭ����ɷ�Ӧ����ʽ�ļ���ϵ����֪����������ͻ�ԭ��������ʵ���֮��Ϊ1:3����С���Ϊ��1:3��
3SO2����N2����4NH3����6H2O��N2���������SO42��SO2����Ԫ�صĻ��ϼ���+6����+4�ۣ�����SO2�ǻ�ԭ����ɷ�Ӧ����ʽ�ļ���ϵ����֪����������ͻ�ԭ��������ʵ���֮��Ϊ1:3����С���Ϊ��1:3��
��4������Ӧ�������н��У��������������ǡ�����������ʹ�ã����д��������մ����ģ������ǹ��������ģ���������Ҫ�ɷ��ǹ����ƣ����ڹ������ʵ�������bcd����С���Ϊ��bcd��

 ȫ�ܲ��һ���þ�ϵ�д�
ȫ�ܲ��һ���þ�ϵ�д�����Ŀ��ijС������֤��Ӧ��Fe+2Ag+=Fe2++2Ag����ʵ���м�Fe3+�����ֺ�̽���������¡�
�������ữ��0.05 mol��L-1��������Һ��pH��2���м���������ۣ�������ã��ձ��ײ��к�ɫ���壬��Һ�ʻ�ɫ��
��1���������
��ȡ������ɫ���壬ϴ�Ӻ�_______�������������֤����ɫ�����к���Ag��
��ȡ�ϲ���Һ���μ�K3[Fe(CN)6]��Һ��������ɫ������˵����Һ�к���_______________��
��2����ԡ���Һ�ʻ�ɫ��������Ϊ��Һ����Fe3+������Ϊ���۹���ʱ��������Fe3+�������ݵ�ԭ����___________________�������ӷ���ʽ��ʾ����������ֹ۵����ʵ�飺
��ȡ�ϲ���Һ���μ�KSCN��Һ����Һ��죬֤ʵ�˼IJ²⡣ͬʱ�����а�ɫ��������������Һ��ɫ��dz��������������ȡ��ʱ���йأ��Ա�ʵ���¼���£�
��� | ȡ��ʱ��/min | ���� |
�� | 3 | ����������ɫ��������Һ�ʺ�ɫ |
�� | 30 | ������ɫ��������3 minʱ���٣���Һ��ɫ��3 minʱ���� |
�� | 120 | ������ɫ��������30 minʱ���٣���Һ��ɫ��30 minʱ��dz |
�����ϣ�Ag+��SCN-���ɰ�ɫ����AgSCN��
�� ��Fe3+������ԭ���������¼��裺
����a�����������۱����������㣬�ܲ���Fe3+��
����b�������д���O2������________�������ӷ���ʽ��ʾ�����ɲ���Fe3+��
����c��������Һ��NO3-���������ԣ��ɲ���Fe3+��
����d������_______�����ж���Һ�д���Ag+���ɲ���Fe3+��
�� ����ʵ����֤ʵ����a��b��c���Dz���Fe3+����Ҫԭ��ʵ����֤ʵ����d������
ʵ����������ữ��________��Һ��pH��2���м���������ۣ�������ã���ͬʱ��ȡ�ϲ���Һ�μ�KSCN��Һ��3 minʱ��Һ��dz��ɫ��30 min����Һ������ɫ��
ʵ���װ����ͼ�����м���Һ��________��������������________________��
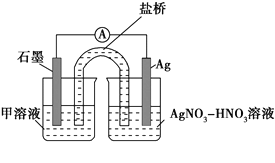
��3������ʵ������Ϸ���ʽ�Ʋ�ʵ�颡~����Fe3+Ũ�ȱ仯��ԭ��______��