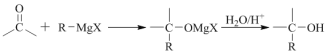
题目内容
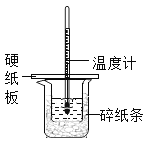
【题目】现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图。
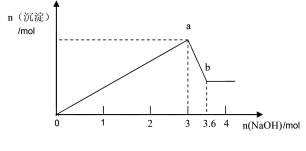
(1)a点对应的沉淀为________________(填化学式)。
(2)计算原混合液中FeCl3的物质的量浓度为多少_______________
【答案】Fe(OH)3和Al(OH)3 4mol/L
【解析】
FeCl3、AlCl3的混合溶液中加入氢氧化钠溶液,先发生的反应(oa段):Fe3++3OH-═Fe(OH)3↓、Al3++3OH-═Al(OH)3↓,当沉淀达到最大量后发生反应(ab):Al(OH)3+OH-═AlO2-+2H2O,
(1)根据分析可知,a点生成的沉淀为Fe(OH)3和Al(OH)3;
(2)ab段氢氧化铝开始溶解,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O;
设FeCl3、AlCl3的物质的量分别为x、y,
0~a段反应,消耗NaOH溶液3mol
Fe3++3OH-═Fe(OH)3↓、Al3++3OH-═Al(OH)3↓,
1mol 3mol 1mol 3mol 1mol
x 3x y 3y y
3x+3y=3mol①
a~b段反应,消耗NaOH溶液(3.6-3)mol
Al(OH)3+OH-═AlO2-+2H2O
1mol 1mol
y y
y=0.6mol②
由①②解得x=0.4mol,
即FeCl3的物质的量为0.6mol,c=0.4mol÷0.1L=4mol·L-1。

练习册系列答案
相关题目