题目内容
【题目】
(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、![]() (PAN)等二次污染物。
(PAN)等二次污染物。
① 1 mol PAN中含有的σ键数目为________。PAN中四种元素的第一电离能由大到小的顺序为________________。
② NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中的中心离子的配位数为________,中心离子的核外电子排布式为________________________。
③ 相同压强下,乙醇的沸点比CH3OCH3________(填“高”或“低”),其原因是_____________。
(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。
① (NH4)2SO4晶体中各种微粒间的作用力不涉及________(填序号)。
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
② NH4NO3中阳离子的空间构型为________,阴离子的中心原子轨道采用________杂化。
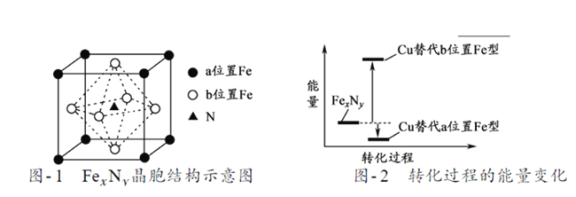
(3)测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如下图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m/n=____________(填数字)。

【答案】10NA (或6.02×1024) N>O>C>H 6 1s22s22p63s23p63d6(或[Ar]3d6) 高 乙醇分子间能形成氢键 de 正四面体形 sp2 3
【解析】
(1)①一个单键就是一个σ键,一个双键中含有一个σ键,一个π键;根据元素周期律,以及第ⅤA族比同周期的ⅥA族第一电离能高,可知N、O、C、H的第一电离能依次减小,据此答题;
②配位体位于方括号中,由1个NO和5个H20分子构成;中心离子为Fe2+,铁是26号元素,所以Fe2+的电子排布式为1s22s22p63s23p63d6,据此答题;
③乙醇分子间能形成氢键,CH3OCH3不能形成分子间氢键,所以相同压强下,乙醇的沸点比CH3OCH3高。据此答题;
(2)①(NH4)2SO4晶体中铵根离子和硫酸根离子之间是离子键,而铵根离子和硫酸根离子内部都是共价键,其中铵根离子内部含一个配位键;
②NH4+的中心原子氮原子价层电子对数=(5+4-1)/2=4,孤电子对=(5-1×4-1)/2=0,所以NH4+的空间构型为正四面体,NO3-的中心原子氮原子价层电子对数=(5+1)/2=3,所以氮原子按sp2方式杂化,据此判断;
(3)Kr晶胞为面心立方密堆积,以顶点Kr原子为研究对象,与之紧相邻的Kr原子处于面心,每个顶点Kr原子为8个晶胞共有,每个晶胞上有3个面心Kr原子与之紧相邻,每个面心Kr原子为2个晶胞共用,与每个Kr原子紧邻的Kr原子有3×8/2=12;晶胞中含Kr原子为8×1/8+6×1/2=4,则m:n=12:4=3,然后求出比值。
(1)①一个单键就是一个σ键,一个双键中含有一个σ键,一个π键,![]() 中共有10个共价键,所以1molPAN中含有的σ键数目为10NA;根据元素周期律,以及第ⅤA族比同周期的ⅥA族第一电离能高,可知N、O、C、H的第一电离能依次减小,即N>O>C>H。本小题答案为:10NA (或6.02×1024;N>O>C>H。
中共有10个共价键,所以1molPAN中含有的σ键数目为10NA;根据元素周期律,以及第ⅤA族比同周期的ⅥA族第一电离能高,可知N、O、C、H的第一电离能依次减小,即N>O>C>H。本小题答案为:10NA (或6.02×1024;N>O>C>H。
②配位体位于方括号中,由1个NO和5个H2O分子构成;中心离子为Fe2+,配位数为6;铁是26号元素,所以Fe2+的电子排布式为1s22s22p63s23p63d6。本小题答案为:6 ;1s22s22p63s23p63d6(或[Ar]3d6)。
③乙醇分子间能形成氢键,CH3OCH3不能形成分子间氢键,所以相同压强下,乙醇的沸点比CH3OCH3高。本小题答案为:高;乙醇分子间能形成氢键。
(2)①(NH4)2SO4晶体中铵根离子和硫酸根离子之间是离子键,而铵根离子和硫酸根离子内部都是共价键,其中铵根离子内部含一个配位键。本小题答案为:de。
②NH4+的中心原子氮原子价层电子对数=(5+4-1)/2=4,孤电子对=(5-1×4-1)/2=0,所以NH4+的空间构型为正四面体,NO3-的中心原子氮原子价层电子对数=(5+1)/2=3,所以氮原子按sp2方式杂化。本小题答案为:正四面体形;sp2。
(3)Kr晶胞为面心立方密堆积,以顶点Kr原子为研究对象,与之紧相邻的Kr原子处于面心,每个顶点Kr原子为8个晶胞共有,每个晶胞上有3个面心Kr原子与之紧相邻,每个面心Kr原子为2个晶胞共用,与每个Kr原子紧邻的Kr原子有3×8/2=12;晶胞中含Kr原子为8×1/8+6×1/2=4,则m:n=12:4=3。本小题答案为:3。

【题目】短周期四种主族元素X、Y、Z、Q在周期表中的位置如图所示。X、Y、W的最外层电子数之和与Q原子核内质子数相等。下列说法中不正确的是( )
X | Y | ||
Z | Q | ||
W |
A. 离子半径![]() :r(Wm-)>r(Qm-)>r(Zn-)
:r(Wm-)>r(Qm-)>r(Zn-)
B. 元素Z和Y的化合价都可能存在![]() 价
价
C. 可以推测HWO4是W的最高价氧化物的水化物
D. X元素的氢化物种类繁多,大多可以与W元素的单质发生反应