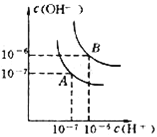
【题目】铁(Fe)、铜(Cu)、银(Ag)是常见的金属元素,它们的单质及其化合物在生活中有广泛应用。
(1)Ag 与 Cu 在同一族,则 Ag 在周期表中________ (填“s”、“p”、“d”或“ds”)区;[Ag(NH3)2]+中 Ag+空的 5s 轨道和 5p 轨道以sp 杂化成键,则该配离子的空间构型是________。
(2)基态 Cu+的简化电子排布式为________。
(3)表中是 Fe 和 Cu 的部分电离能数据:请解释 I2(Cu)大于 I2(Fe)的主要原因:________。
元素 | Fe | Cu |
第一电离能 I1/kJ·mol-1 | 759 | 746 |
第二电离能 I2/kJ·mol-1 | 1561 | 1958 |
(4)亚铁氰化钾是食盐中常用的抗结剂,其化学式为 K4[Fe(CN)6]。
①CN-的电子式是________;1mol 该配离子中含σ 键数目为________。
②该配合物中存在的作用力类型有________ (填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力
(5)氧化亚铁晶体的晶胞结构如图所示。已知:
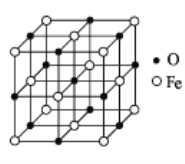
氧化亚铁晶体的密度为 ρgcm﹣3,NA代表阿伏加德罗常数的值。在该晶胞中,与 Fe2+紧邻且等距离的 Fe2+数目为________,Fe2+与O2﹣最短核间距为________pm。
【题目】根据下列操作和现象,所得结论正确的是
选项 | 实验操作及现象 | 实验结论 |
A | 向 NaCl、NaI 的混合稀溶液中滴入少量稀 AgNO3 溶液,先有黄色沉淀生成 | Ksp(AgCl)>Ksp(AgI) |
B | 将硫酸酸化的 H2O2 溶液滴入 Fe(NO3)2 溶液中,溶液变黄 | 证明氧化性:H2O2>Fe3+ |
C | 常温下,用 pH 计测定 0.1 mol·L-1 NaA 溶液的 pH 小于 0.1 mol·L-1Na2CO3 溶液的 pH | 能证明酸性:HA>H2CO3 |
D | 取 a g 铝箔与足量氢氧化钠溶液充分反应,逸出的气体通过浓硫酸后,测其体积为 V L(标准状况下) | 测定铝箔中 Al2O3 含量 |
A.AB.BC.CD.D