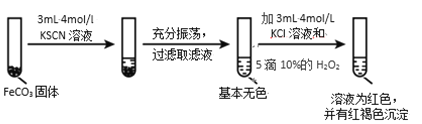
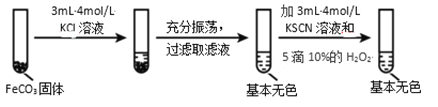
ЬтФПФкШн
ЁОЬтФПЁПЬњ(Fe)ЁЂЭ(Cu)ЁЂвј(Ag)ЪЧГЃМћЕФН№ЪєдЊЫиЃЌЫќУЧЕФЕЅжЪМАЦфЛЏКЯЮядкЩњЛюжагаЙуЗКгІгУЁЃ
(1)Ag гы Cu дкЭЌвЛзхЃЌдђ Ag дкжмЦкБэжа________ (ЬюЁАsЁБЁЂЁАpЁБЁЂЁАdЁБЛђЁАdsЁБ)ЧјЃЛ[Ag(NH3)2]+жа Ag+ПеЕФ 5s ЙьЕРКЭ 5p ЙьЕРвдsp дгЛЏГЩМќЃЌдђИУХфРызгЕФПеМфЙЙаЭЪЧ________ЁЃ
(2)ЛљЬЌ Cu+ЕФМђЛЏЕчзгХХВМЪНЮЊ________ЁЃ
(3)БэжаЪЧ Fe КЭ Cu ЕФВПЗжЕчРыФмЪ§ОнЃКЧыНтЪЭ I2(Cu)Дѓгк I2(Fe)ЕФжївЊдвђЃК________ЁЃ
дЊЫи | Fe | Cu |
ЕквЛЕчРыФм I1/kJЁЄmolЃ1 | 759 | 746 |
ЕкЖўЕчРыФм I2/kJЁЄmolЃ1 | 1561 | 1958 |
(4)бЧЬњЧшЛЏМиЪЧЪГбЮжаГЃгУЕФПЙНсМСЃЌЦфЛЏбЇЪНЮЊ K4[Fe(CN)6]ЁЃ
ЂйCN-ЕФЕчзгЪНЪЧ________ЃЛ1mol ИУХфРызгжаКЌІв МќЪ§ФПЮЊ________ЁЃ
ЂкИУХфКЯЮяжаДцдкЕФзїгУСІРраЭга________ (ЬюзжФИ)ЁЃ
A.Н№ЪєМќ B.РызгМќ C.ЙВМлМќ D.ХфЮЛМќ E.ЧтМќ F.ЗЖЕТЛЊСІ
(5)бѕЛЏбЧЬњОЇЬхЕФОЇАћНсЙЙШчЭМЫљЪОЁЃвбжЊЃК
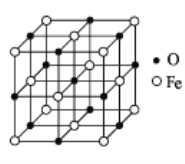
бѕЛЏбЧЬњОЇЬхЕФУмЖШЮЊ ІбgcmЉ3ЃЌNAДњБэАЂЗќМгЕТТоГЃЪ§ЕФжЕЁЃдкИУОЇАћжаЃЌгы Fe2+НєСкЧвЕШОрРыЕФ Fe2+Ъ§ФПЮЊ________ЃЌFe2+гыO2ЉзюЖЬКЫМфОрЮЊ________pmЁЃ
ЁОД№АИЁПds жБЯпаЮ [Ar]3d10 ЪЇШЅЕкЖўИіЕчзгЪБЃЌCu ЪЇШЅЕФЪЧШЋГфТњ 3d10 ЕчзгЃЌFe ЪЇШЅЕФЪЧ 4s1 Ечзг ![]() 12NA BCD 12
12NA BCD 12 ![]() ЁС1010
ЁС1010
ЁОНтЮіЁП
(1)AgдкЕкЮхжмЦкЕкЂёBзхЃЛвРЬтвтЃК[Ag(NH3)2]+жаAg+вдspдгЛЏГЩМќЃЛ
(2)ЭЪЧ29КХдЊЫиЃЌЗжЮіCuЃЋЛљЬЌКЫЭтЕчзгХХВМЪНЃЛ
(3)ИљОнЕчзгХХВМЗжЮіЃЛ
(4)ЂйCN-гыN2ЪЧЕШЕчзгЬхЃЌНсЙЙЯрЫЦЃЌИљОнЕЊЦјЕчзгЪНЪщаДЃЛCN-гыFe2+вдХфЮЛМќНсКЯЃЌет6ИіХфЮЛМќЖМЪєгкІвМќЃЌЛЙга6ИіCN-жаИїгавЛИіІвМќЃЛ
ЂкИљОнK4 [Fe(CN)6]ЗжзгЪНЗжЮіЃЛ
(5)ИљОнОЇАћЃЌFe2+ЮЊУцаФСЂЗНЃЌгыFe2+НєСкЧвЕШОрРыЕФFe2+Ъ§ФПЮЊ12ИіЃЛОЇАћВЮЪ§ЕШгкЯрСкСНИіРызгКЫМфОрЕФ2БЖЁЃ
(1)AgдкЕкЮхжмЦкЕкЂёBзхЃЌЪєгкdsЧјЃЛвРЬтвтЃК[Ag(NH3)2]+жаAg+вдspдгЛЏГЩМќЃЌгІИУЪЧжБЯпаЮЃЌЙЪД№АИЮЊЃКdsЃЛжБЯпаЮЃЛ
(2)ЭЪЧ29КХдЊЫиЃЌCuЃЋЛљЬЌКЫЭтЕчзгХХВМЪНЮЊ[Ar]3d10ЃЌЙЪД№АИЮЊЃК[Ar]3d10ЃЛ
(3)Cu+ЕФМлЕчзгХХВМЪНЮЊ3d10ЃЌFe+ЕФМлЕчзгХХВМЪНЮЊ3d64s1ЃЌCu+дйЪЇШЅЕФЪЧ3d10ЩЯЕФЕчзгЃЌЖјFe+ЪЇШЅЕФЪЧ4s1ЕФЕчзгЃЌгЩгкдзгКЫЭтЕчзгДІгкШЋГфТњЁЂАыГфТњЛђШЋПеЪБЪЧЮШЖЈЕФзДЬЌЃЌЯдШЛ3d10ДІгкШЋГфТњЃЌИќЮШЖЈЃЌЫљвдЪЇШЅЕкЖўИіЕчзгЪБЃЌCu ЪЇШЅЕФЪЧШЋГфТњ 3d10 ЕчзгЃЌашвЊЕФФмСПИпЃЌЖјFe ЪЇШЅЕФЪЧ4s1 ЕчзгЃЌЫљашФмСПЕЭЃЌЙЪД№АИЮЊЃКЪЇШЅЕкЖўИіЕчзгЪБЃЌCu ЪЇШЅЕФЪЧШЋГфТњ 3d10 ЕчзгЃЌFe ЪЇШЅЕФЪЧ 4s1 ЕчзгЃЛ
(4)ЂйCN-гыN2ЪЧЕШЕчзгЬхЃЌНсЙЙЯрЫЦЃЌИљОнЕЊЦјЕчзгЪНЪщаДЧтЧшИљРызгЕчзгЪНЮЊ![]() ЃЛCN-гыFe2+вдХфЮЛМќНсКЯЃЌет6ИіХфЮЛМќЖМЪєгкІвМќЃЌЛЙга6ИіCN-жаИїгавЛИіІвМќЃЌ1ИіХфРызгжаКЌгаЕФІвМќЙВга12ИіЃЌдђ1molИУХфРызгжаКЌга 12 NAИіІвМќЃЌЙЪД№АИЮЊЃК
ЃЛCN-гыFe2+вдХфЮЛМќНсКЯЃЌет6ИіХфЮЛМќЖМЪєгкІвМќЃЌЛЙга6ИіCN-жаИїгавЛИіІвМќЃЌ1ИіХфРызгжаКЌгаЕФІвМќЙВга12ИіЃЌдђ1molИУХфРызгжаКЌга 12 NAИіІвМќЃЌЙЪД№АИЮЊЃК![]() ЃЛ12NAЃЛ
ЃЛ12NAЃЛ
ЂкK4 [Fe(CN)6]ЪЧРызгЛЏКЯЮяЃЌКЌгаРызгМќЃЌбєРызгK+гыХфРызгжЎМфвдРызгМќНсКЯЃЌFe2+гыCN-вдХфЮЛМќНсКЯЃЌCN-жаЕФСНжждзгвдМЋадЙВМлМќНсКЯЃЌ ЙЪД№АИЮЊЃКBCDЃЛ
(5)ИљОнОЇАћЃЌFe2+ЮЊУцаФСЂЗНЃЌгыFe2+НєСкЕФЕШОрРыЕФFe2+га12ИіЃЛгУЁАОљЬЏЗЈЁБЃЌОЇАћжаКЌFe2+ЃК8![]() +6
+6![]() =4ИіЃЌКЌO2-ЃК12
=4ИіЃЌКЌO2-ЃК12![]() +1=4ИіЃЌОЇЬхЕФЛЏбЇЪНЮЊFeOЃЌ1molFeOЕФжЪСПЮЊ72gЃЌ1molОЇЬхЕФЬхЛ§ЮЊ
+1=4ИіЃЌОЇЬхЕФЛЏбЇЪНЮЊFeOЃЌ1molFeOЕФжЪСПЮЊ72gЃЌ1molОЇЬхЕФЬхЛ§ЮЊ![]() cm3ЃЛОЇАћЕФЬхЛ§ЮЊ
cm3ЃЛОЇАћЕФЬхЛ§ЮЊ![]() cm3
cm3![]() NA
NA![]() 4=
4=![]() cm3ЃЌОЇАћЕФБпГЄЮЊ
cm3ЃЌОЇАћЕФБпГЄЮЊ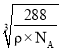 cmЃЌFe2+гыO2-зюЖЬКЫМфОрЮЊ
cmЃЌFe2+гыO2-зюЖЬКЫМфОрЮЊ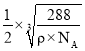 cm=
cm=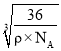 cm=
cm=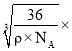 1010pmЃЌЙЪД№АИЮЊЃК12ЃЛ
1010pmЃЌЙЪД№АИЮЊЃК12ЃЛ![]() ЁС1010ЁЃ
ЁС1010ЁЃ

ЁОЬтФПЁПгћгУ98%ЕФХЈСђЫс(gЃН1.84gЁЄcmЃ3)ХфжЦГЩХЈЖШЮЊ0.5molЁЄLЃ1ЕФЯЁСђЫс500mlЁЃ
(1)бЁгУЕФжївЊвЧЦїгаЃК
Ђй__________ЃЌЂк__________ЃЌЂл__________ЃЌЂм____________ЃЌЂн____________ЁЃ
(2)ЧыНЋЯТСаИїВйзїЃЌАДе§ШЗЕФађКХЬюдкКсЯпЩЯЁЃ
AЃЎгУСПЭВСПШЁХЈH2SO4 |
BЃЎЗДИДЕпЕЙвЁдШ |
CЃЎгУНКЭЗЕЮЙмМгеєСѓЫЎжСПЬЖШЯп |
DЃЎЯДОЛЫљгУвЧЦї |
EЃЎЯЁЪЭХЈH2SO4
FЃЎНЋШмвКзЊШыШнСПЦП
ЦфВйзїе§ШЗЕФЫГађвРДЮЮЊ______________________ЁЃ
(3)МђвЊЛиД№ЯТСаЮЪЬтЃК
ЂйЫљашХЈСђЫсЕФЬхЛ§ЮЊ____________mLЁЃ
ЂкШчЙћЪЕбщЪвга15mLЁЂ20mLЁЂ50mLЕФСПЭВгІбЁгУ____________mLЕФСПЭВзюКУЃЌСПШЁЪБЗЂЯжСПЭВВЛИЩОЛгУЫЎЯДОЛКѓжБНгСПШЁНЋЪЙХЈЖШ__________(ЁАЦЋИпЁБЁЂЁАЦЋЕЭЁБЁЂЁАЮогАЯьЁБ)
ЂлНЋХЈСђЫсбиЩеБФкБкТ§Т§зЂШыЪЂЫЎЕФЩеБжаЃЌВЂгУВЃСЇАєВЛЖЯНСАшЕФФПЕФЪЧ____________ЃЌШєНСАшЙ§ГЬжагавКЬхНІГіНсЙћЛсЪЙХЈЖШЦЋ____________ЁЃ
ЂмдкзЊШыШнСПЦПЧАЩеБжавКЬхгІ____________ЃЌЗёдђЛсЪЙХЈЖШЦЋ____________ЃЛВЂЯДЕгЩеБКЭВЃСЇАє2ЁЋ3ДЮЃЌЯДЕгвКвВвЊзЊШыШнСПЦПЃЌЗёдђЛсЪЙХЈЖШ____________ЁЃ
ЂнЖЈШнЪББиаыЪЙШмвКАМвКУцгыПЬЖШЯпЯрЧаЃЌШєИЉЪгЛсЪЙХЈЖШ____________ЃЛбіЪгдђЪЙХЈЖШ___________ЁЃ