题目内容
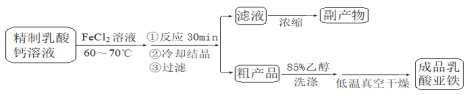
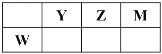
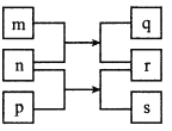
【题目】短周期主族元素 W、X、Y、Z 的原子序数依次增大,X 的质子数是 W 与 Z 的质子数之和的一半。m、n、p 是由这些元素组成的二元化合物,r 是元素 Y 的气体单质,n 为淡黄色粉末, 相关物质转化关系如图所示。室温下,0.01mol/L s 溶液 pH 为 12。下列说法误错的是
A.Z 是所在周期中原子半径最大的元素
B.简单离子半径大小:Y﹥Z﹥W
C.电负性:Y﹥X﹥W
D.n 中阴阳离子个数比为 1:1
【答案】D
【解析】
由已知条件可推出n为Na2O2、s为NaOH、r为O2、p为H2O,W、X、Y、Z分别为H、C、O、Na。
A. Z是Na,同一周期,原子序数增大,原子半径减小,所以Z是所在周期中原子半径最大的元素,A项正确;
B. W、Y、Z对应的简单离子分别为:H+、O2-、Na+,电子层结构相同的离子,核电荷数越大,半径越小,可知简单离子半径大小:Y﹥Z﹥W,B项正确;
C. 非金属性:O﹥C﹥H,则电负性:O﹥C﹥H,C项正确;
D. n为Na2O2,1个Na2O2有两个钠离子和一个过氧根离子,则阴阳离子个数比为 2:1,D项错误;
答案选D。

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目