题目内容
【题目】I.水的电离平衡线如图所示.若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点
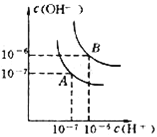
(1)在100℃时,Kw表达式为_______,在此温度下,kw为___.
(2)在室温下,将pH=9的Ba(OH)2溶液与pH=5的稀盐酸混合,欲使混合溶液pH=7则Ba(OH)2与盐酸的体积比为____.
(3)室温时将PH为3的硫酸溶液稀释100倍,稀释后溶液中,C(SO42-)和C(H+)之比约为___.
II.今有①CH3COOH ②HCl ③H2SO4三种溶液.根据要求回答下列问题:
(1)写出①的电离方程式_______.
(2)当它们pH相同时,其物质的量浓度最大的是___(填序号).
(3)当它们的物质的量浓度相同时,其pH最小是___(填序号).
(4)在室温下,将c(H+)均为0.01mol/L的三种酸分别加水稀释至原来的10倍,c(H+)由大到小的顺序为___(填序号).
(5)体积和物质的量浓度均相同的①②③三种酸溶液,分别与相同浓度的烧碱溶液恰好完全反应,所需烧碱的体积比为____.
(6)三酸的pH相同时,若耗等量的Zn,则需三酸的体积大小关系为___(填序号).
【答案】Kw=c(H+)·c(OH-) 1×10-12 1:1 1:2 CH3COOH![]() CH3COO—+H+ ① ③ ①>②=③ 1:1:2 ①<②=③
CH3COO—+H+ ① ③ ①>②=③ 1:1:2 ①<②=③
【解析】
Ⅰ.(1)在100℃时,Kw表达式为Kw=c(H+)·c(OH-),由图像可知,在此温度下c(OH-)=c(H+)=1×10-6mol/L,则Kw=c(H+)·c(OH-)=1×10-6×1×10-6=1×10-12,故答案为:Kw=c(H+)·c(OH-),1×10-12。
(2)在室温下,将pH=9的Ba(OH)2溶液中:c(OH-)=10-5mol/L,pH=5的稀盐酸中:c(H+)=10-5mol/L,设氢氧化钡的体积为x,盐酸的体积为y,在室温下混合溶液的pH=7,溶液呈中性,则:n(OH-)=n(H+)即10-5mol/L×x=10-5mol/L×y,解得x:y=1:1,则Ba(OH)2与盐酸的体积比为1:1,故答案为:1:1。
(3)室温时,pH=3的硫酸溶液中,c(H+)=10-3mol·L-1,c(SO42—)=5×10-4mol·L-1,将此溶液稀释500倍后,稀释液中c(SO42—)=1×10-6mol·L-1,而c(H+)=2×10-6mol·L-1,则c(SO42—)∶c(H+)约为1×10-6mol·L-1:2×10-6mol·L-1=1∶2,故答案为:1:2。
Ⅱ.(1)CH3COOH为弱电解质,在水溶液中部分发生电离,电离方程式为:CH3COOH![]() CH3COO—+H+,故答案为:CH3COOH
CH3COO—+H+,故答案为:CH3COOH![]() CH3COO—+H+。
CH3COO—+H+。
(2)当它们pH相同时,溶液中氢离子浓度相同,假设提供1mol/L的氢离子,需要醋酸浓度应大于1mol/L;需要②HCl溶液浓度为1mol/L;、需要③H2SO4溶液浓度为0.5mol/L,其物质的量浓度最大的是①,故答案为:①。
(3)当它们的物质的量浓度相同时,假设浓度都是1mol/L;①CH3COOH溶液电离出氢离子浓度小于1mol/L、②HCl电离出氢离子浓度为1mol/L、③H2SO4电离出的氢离子浓度为2mol/L;其pH最小的是③,故答案为:③。
(4)加水稀释时,醋酸继续电离出氢离子,硫酸和HCl不再电离出氢离子,所以稀释100倍后,c(H+)由大到小的顺序是①>②=③;故答案为:①>②=③。
(5)体积和物质的量浓度均相同的①②③三种酸溶液,醋酸和盐酸是一元酸,硫酸是二元酸,分别与相同浓度的烧碱溶液恰好完全反应,所需烧碱的体积比为1:1:2,故答案为:1:1:2。
(6)盐酸和硫酸是强酸,醋酸是弱酸,三酸的pH相同时,若耗等量的Zn,则需三酸的体积大小关系为①<②=③,故答案为:①<②=③。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】回答下列问题
(1)等pH、等体积的两份溶液A(盐酸)和B(CH3COOH)分別与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是_____(填写序号)。
①开始反应时的速率A>B ②参加反应的锌的物质的量A=B
③反应所需要的时间B>A ④A中有锌剩余
(2)已知,CH3COOH是常见的弱酸,现有常温下0.1molL-1的CH3COOH溶液。
①温度不变,加水稀释过程中,下列表达式的数据一定变小的是_____(填字母序号,下同),②若该溶液升高温度,下列表达式的数据增大的是_____。
A.c(H+) B.c(H+)·c(OH-)
C.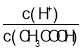 D.
D.![]()
(3)取0.10mol CH3COOH(冰醋酸)作导电性实验,测得其导电率随加入的水量变化如图所示:比较a、b点的相关性质(填“>”“<”或“=”):
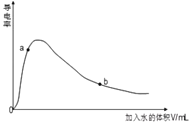
① n(H+):a_____b;
② c(CH3COO-):a_____b;
③完全中和时消耗NaOH的物质的量:a_____b;
(4)25℃时,部分物质的电离平衡常数如下表所示:
CH3COOH | H2CO3 | HCN |
1.7×10﹣5 | K1=4.3×10-7 K2=5.6×10﹣11 | 4.9×10﹣10 |
请回答下列问题:
① CH3COOH、H2CO3、HCN的酸性由强到弱的顺序为_________。
② 焦炉煤气中一般含有H2S和HCN气体,有的工厂在真空条件下,使用K2CO3溶液吸收煤气中的H2S和HCN气体,实现脱硫脱氰。请根据上述数据,尝试从理论上推测同为0.l molL-1的K2CO3溶液和HCN混合后,最可能发生的反应的离子方程式_____。
【题目】根据下列操作和现象,所得结论正确的是
选项 | 实验操作及现象 | 实验结论 |
A | 向 NaCl、NaI 的混合稀溶液中滴入少量稀 AgNO3 溶液,先有黄色沉淀生成 | Ksp(AgCl)>Ksp(AgI) |
B | 将硫酸酸化的 H2O2 溶液滴入 Fe(NO3)2 溶液中,溶液变黄 | 证明氧化性:H2O2>Fe3+ |
C | 常温下,用 pH 计测定 0.1 mol·L-1 NaA 溶液的 pH 小于 0.1 mol·L-1Na2CO3 溶液的 pH | 能证明酸性:HA>H2CO3 |
D | 取 a g 铝箔与足量氢氧化钠溶液充分反应,逸出的气体通过浓硫酸后,测其体积为 V L(标准状况下) | 测定铝箔中 Al2O3 含量 |
A.AB.BC.CD.D
【题目】使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL)。
Ⅰ.实验步骤:
(1)配制100mL待测白醋溶液。量取10.00mL食用白醋,注入烧杯中用水稀释后转移到___________(填仪器名称)中定容,摇匀即得。
(2)用________取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴___作指示剂。
(3)读取盛装0.1000 mol/L NaOH 溶液的___________(填仪器名称)的初始读数。如果液面位置如图所示,则此时的读数为_________mL。

(4)滴定。当______________________________________________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录
滴定次数 | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
(1)经计算,市售白醋总酸量=_____________g/100mL。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是______(填写序号)。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出