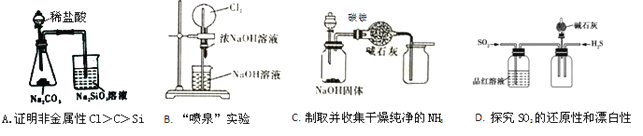
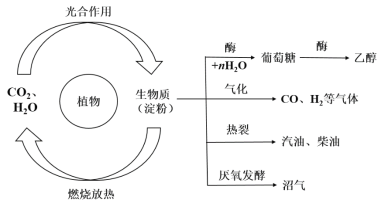
题目内容
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是
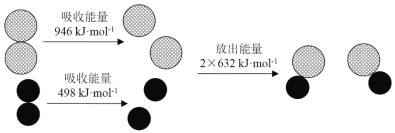
A. 1 mol N2(g)和NA个O2(g)反应放出的能量为180 kJ
B. 1 mol N2(g)和1 mol O2(g)具有总能量小于2 mol NO(g)具有的总能量
C. 通常情况下,N2(g)和O2(g)混合能直接生成NO(g)
D. 吸热反应一定需要加热才能发生
【答案】B
【解析】
A.焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,N2+O2=2NO,△H=946kJ/mol+498kJ/mol-2×632kJ/mol=180kJ/mol,故该反应是吸热反应,故A错误;B.依据A计算可知反应是吸热反应,故1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量,故B正确;C.通常情况下,N2(g)和O2(g)混合不能直接生成NO,在放电或高温条件才能反应,故C错误;D.吸热反应不一定需要加热,如氢氧化钡晶体与氯化铵固体的反应,在常温下就能进行,但该反应为吸热反应,故D错误;故选B。

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案【题目】已知某醇燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验结果(假设产生的气体完全被吸收):

实验前 | 实验后 | |
(干燥剂+U形管)的质量 | 101.1g | 102.9g |
(石灰水+广口瓶)的质量 | 312.0g | 314.2g |
根据实验数据求:
(1)实验完毕后,生成物中水的质量为 __________ g,假设广口瓶里生成一种正盐,其质量为 __________ g;
(2)生成的水中氢元素的质量为 __________ g;
(3)生成的二氧化碳中碳元素的质量为 __________ g;
(4)该燃料中碳元素与氢元素的物质的量之比为 __________ ;
(5)已知这种醇的每个分子中含有一个氧原子,则该醇的分子式为 __________ ,结构简式为 __________ .