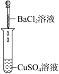
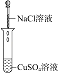
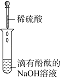
【题目】为了确认电解质溶液中部分离子相互间能否发生反应,及离子反应发生的条件,做如表四组实验:
编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
实验 |
|
|
|
|
(1)实验Ⅰ的现象________,写出反应的离子方程式________。
(2)实验Ⅱ的目的是________。
(3)实验Ⅲ的现象证明了溶液中的________两种离子之间发生了化学反应。
(4)实验Ⅳ中发生反应的离子方程式是________。
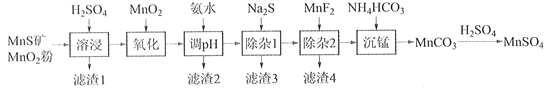
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnz2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___________。
时,z=___________。
【题目】下表中对离子方程式的评价合理的是
选项 | 化学反应及其离子方程式 | 评价 |
A | H2SO4溶液与Ba(OH)2溶液反应: H++ SO42-+Ba2++OH | 正确 |
B | 向碳酸镁浊液中加入足量稀盐酸: CO32-+2H+ | 错误,碳酸镁不应写成离子形式 |
C | 向沸水中滴加饱和的氯化铁溶液至液体变为红褐色:Fe3++3H2O | 正确 |
D | 向NaOH溶液中通入少量CO2反应:OH+CO2 | 正确 |
A. A B. B C. C D. D