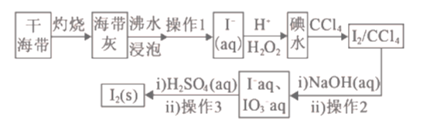
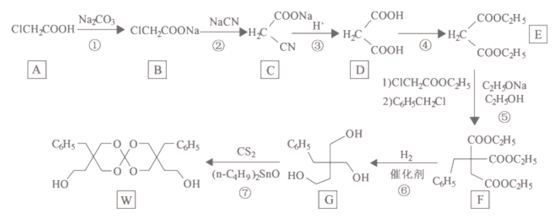
题目内容
【题目】为了确认电解质溶液中部分离子相互间能否发生反应,及离子反应发生的条件,做如表四组实验:
编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
实验 |
|
|
|
|
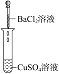
(1)实验Ⅰ的现象________,写出反应的离子方程式________。
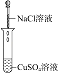
(2)实验Ⅱ的目的是________。
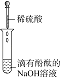
(3)实验Ⅲ的现象证明了溶液中的________两种离子之间发生了化学反应。
(4)实验Ⅳ中发生反应的离子方程式是________。
【答案】有白色沉淀产生 Ba2++SO42-=BaSO4↓ 验证Cl﹣与Cu2+不发生反应 H+、OH﹣ CaCO3+2H+═Ca2++CO2↑+H2O
【解析】
(1)氯化钡和硫酸铜反应生成硫酸钡沉淀;
(2)检验氯离子与铜离子是否反应;
(3)发生中和反应,溶液由红色变为无色;
(4)盐酸和碳酸钙反应生成氯化钙、水和二氧化碳。
(1)氯化钡和硫酸铜反应生成硫酸钡白色沉淀,反应的离子方程式为:Ba2++SO42-=BaSO4↓;
(2)实验Ⅰ溶液中还存在氯离子和铜离子,实验Ⅱ可验证Cl-与Cu2+不发生反应;
(3)发生中和反应,溶液由红色变为无色,说明H+、OH-发生反应;
(4)盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,反应的离子方程式为CaCO3+2H+═Ca2++CO2↑+H2O。

练习册系列答案
相关题目