题目内容
【题目】电解Na2CO3溶液的工作原理如图所示。下列说法错误的是
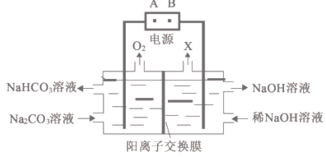
A.A为电源的正极
B.X为氢气
C.工作时,Na+向左室迁移
D.阳极的电极反应式为4CO32-+2H2O-4e-=4HCO3-+O2↑
【答案】C
【解析】
A. 在电解池左侧,溶液中OH-失去电子被氧化为O2,所以左侧电极为阳极,则电极A为正极,B为负极,A正确;
B. B为负极,电解池右侧电极为阴极,发生还原反应:电极反应式为2H++2e-=H2↑,所以X为氢气,B正确;
C. 由图示可知离子交换膜为阳离子交换膜,所以工作时,溶液中的阳离子Na+由左室向负电荷较多的右室迁移,C错误;
D. 电池工作时,由于离子放电能力OH->CO32-,所以首先发生反应:4OH--4e-=2H2O+O2↑,OH-放电,破坏了附近的水的电离平衡,使附近溶液中H+浓度增大,产生的H+与CO32-结合形成HCO3-,H++CO32-=HCO3-,总电极反应式为:4CO32-+2H2O-4e-=4HCO3-+O2↑,D正确;
故合理选项是C。

练习册系列答案
相关题目