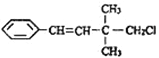
题目内容
【题目】(1)现有下列几种有机物:①乙炔、②乙醇、③乙醛、④乙酸、⑤甲酸乙酯、⑥苯酚、⑦溴乙烷。其中: 能与 Na2CO3 溶液反应产生气泡的是___(填序号,下同);遇氯化铁溶液呈紫色的是________;能发生银镜反应的是_____;不能使酸性 KMnO4 溶液褪色的是______。
(2)按要求写出下列反应方程式
①实验室制取乙炔:____________
②实验室制取乙烯:________
【答案】④ ⑥ ③⑤ ④⑦ CaC2+2H2O → C2H2↑+Ca(OH)2 CH3─CH2OH ![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
【解析】
(1)-COOH能与Na2CO3溶液反应产生气泡;含酚羟基的物质能与FeCl3溶液发生显色反应;-CHO能发生银镜反应;还原性的有机物能使酸性 KMnO4 溶液褪色,如含有碳碳双键、-CHO等;
(2)①实验室利用碳化钙和水反应制取乙炔;
②实验室利用乙醇和浓硫酸混合加热至170℃制取乙烯;
(1)-COOH能与Na2CO3溶液反应产生气泡,乙酸中含有-COOH,则能与Na2CO3 溶液反应产生气泡的是④;含酚羟基的物质能与FeCl3溶液发生显色反应,苯酚中含有酚羟基,则遇氯化铁溶液呈紫色的是⑥;-CHO能发生银镜反应,乙醛和甲酸乙酯中含有-CHO,则能发生银镜反应的是③⑤;乙炔、乙醇、乙醛、甲酸乙酯、苯酚均有还原性,能使酸性 KMnO4 溶液褪色,则不能使酸性KMnO4 溶液褪色是乙酸、溴乙烷,即④⑦;
(2)①实验室利用碳化钙和水反应制取乙炔,发生反应的化学方程式为CaC2+2H2O → C2H2↑+Ca(OH)2;
②实验室利用乙醇和浓硫酸混合加热至170℃制取乙烯,发生反应的化学方程式为CH3─CH2OH ![]() CH2=CH2↑+H2O。
CH2=CH2↑+H2O。

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案【题目】I:已知:反应aA(g)+bB(g) ![]() cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
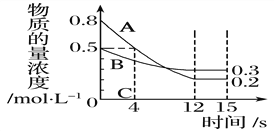
(1)经测定前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为_______________________
(2)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L-1·s-1; 乙:v(B)=0.12 mol·L-1·s-1; 丙:v(C)=9.6 mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为__________________(用甲、乙、丙表示)。
Ⅱ: 某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折合成标准状况),实验记录如表(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 | 6 |
氢气体积/mL | 50 | 120 | 224 | 392 | 472 | 502 |
(3)哪一时间段反应速率最大__(填0~1、1~2、2~3、3~4、4~5、5~6 min,下同),原因是_______________________________________________________
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是__________(填字母)
A.CH3COONa B.NaNO3溶液 C.KCl溶液 D.Na2CO3溶液
Ⅲ:(5)下列说法可以证明H2(g)+I2(g)![]() 2HI(g)已达平衡状态的是______________________
2HI(g)已达平衡状态的是______________________
A.单位时间内生成n mol H2的同时,生成n mol HI
B.一个H—H键断裂的同时有两个H—I键断裂
C.温度和体积一定时,混合气体颜色不再变化
D.反应速率v(H2)=v(I2)=![]() v(HI)
v(HI)
E.温度和体积一定时,容器内压强不再变化
F.温度和体积一定时,混合气体的密度不再变化
【题目】一种用富锰渣(主要成分为MnCO3以及Fe、Ba及Al的盐类或氧化物及少量重金属盐等)制备MnCl2的工艺流程如下:

回答下列问题:
(1)“溶浸”时,为了提高锰的浸取率,列举2条有效的措施:___________,写出该步中MnCO3参与反应的化学方程式:__________。
(2)“氧化”时,主要反应的离子方程式为______________。
(3)滤渣2的主要成分为______(填化学式);简述产生该滤渣的原理:______。
(4)已知部分重金属硫化物的溶度积如表:
硫化物 | MnS | PbS | CuS | NiS |
Ksp | 1.32×10-10 | 1.32×10-27 | 1.32×10-35 | 2.82×10-20 |
①“除重金属”时,溶液的pH调到4.5~6.0,pH不宜过低的原因是_______。
②若表中四种金属离子浓度相同,滴入Na2S溶液时首先被沉淀的离子是_______,反应MnS(s)+Cu2+(aq)![]() CuS(s)+Mn2+(aq)的平衡常数K=______。
CuS(s)+Mn2+(aq)的平衡常数K=______。