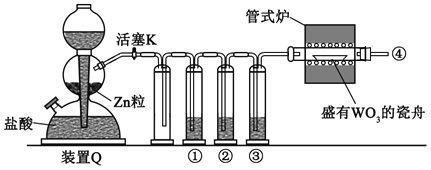
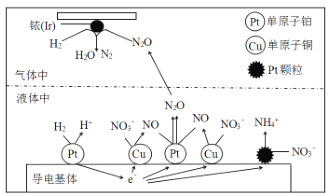
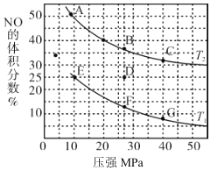
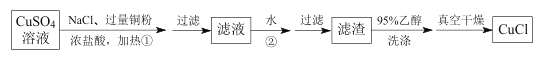
0 196766 196774 196780 196784 196790 196792 196796 196802 196804 196810 196816 196820 196822 196826 196832 196834 196840 196844 196846 196850 196852 196856 196858 196860 196861 196862 196864 196865 196866 196868 196870 196874 196876 196880 196882 196886 196892 196894 196900 196904 196906 196910 196916 196922 196924 196930 196934 196936 196942 196946 196952 196960 203614