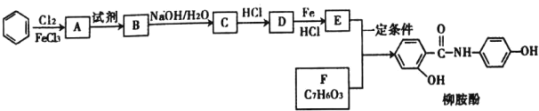
题目内容
【题目】以重晶石(BaSO4为主,含有钙等杂质)为原料,可按如下工艺生产碳酸钡:
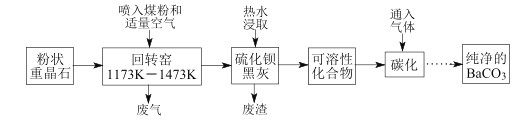
温度为1173K~1473K时回转窑中发生的主要反应:C+O2![]() CO2,C+CO2
CO2,C+CO2![]() 2CO;BaSO4+4C
2CO;BaSO4+4C![]() BaS+4CO↑,BaSO4+2C
BaS+4CO↑,BaSO4+2C![]() BaS+2CO2↑。
BaS+2CO2↑。
(1)煤粉的主要作用是______________。
(2)若回转窑中通过量空气,则BaCO3产率________(填“降低”、“升高”、“不变”)。
(3)用 90~95℃的热水浸取BaS转化为可溶性化合物时无气体生成,此过程反应的化学方程式__________________。
(4)在回转窑产生的废气,其中________可以在碳化过程得到重新利用;硫化钡黑灰热水浸取,保温后热过滤除去的残渣也可在其他工业生产中再利用,如废渣中的 CaSO4可作 ____________(写一种即可)。
(5)为了得到纯净的BaCO3,省略的操作是_____________________。
(6)已知反应BaSO4(s)+CO32-(aq)![]() BaCO3(s)+SO42-(aq),某同学利用该反应在实验室模拟BaSO4转化为BaCO3的过程:若每次加入1 L 2 mol/L的Na2CO3溶液,至少需要____次,可以将0.3 mol BaSO4完全转化为BaCO3。[Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=5×10-9]
BaCO3(s)+SO42-(aq),某同学利用该反应在实验室模拟BaSO4转化为BaCO3的过程:若每次加入1 L 2 mol/L的Na2CO3溶液,至少需要____次,可以将0.3 mol BaSO4完全转化为BaCO3。[Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=5×10-9]
【答案】燃烧供热和作还原剂 降低 2BaS+2H2O![]() Ba(HS)2+Ba(OH)2 CO2 建筑材料、制石膏 过滤、洗涤、干燥 8
Ba(HS)2+Ba(OH)2 CO2 建筑材料、制石膏 过滤、洗涤、干燥 8
【解析】
在回转窑中C与O2反应产生CO2、CO,同时放出大量的热,C与BaSO4反应产生BaS,然后将BaS、C的混合物用热水浸取,发生反应2BaS+2H2O![]() Ba(HS)2+Ba(OH)2,过滤除去C单质,向可溶性混合物的水溶液中通入适量CO2气体,反应产生BaCO3沉淀,再经过滤、洗涤、干燥可得到纯净的BaCO3。
Ba(HS)2+Ba(OH)2,过滤除去C单质,向可溶性混合物的水溶液中通入适量CO2气体,反应产生BaCO3沉淀,再经过滤、洗涤、干燥可得到纯净的BaCO3。
(1)在回转窑中加入煤粉和重晶石,在温度为1173K~1473K时回转窑中发生的主要反应:C+O2![]() CO2,C+CO2
CO2,C+CO2![]() 2CO;BaSO4+4C
2CO;BaSO4+4C![]() BaS+4CO↑,BaSO4+2C
BaS+4CO↑,BaSO4+2C![]() BaS+2CO2↑;煤粉燃烧放出大量的热,且C与BaSO4反应生成BaS的反应中C为还原剂,可见煤粉的主要作用是燃烧供热和作还原剂;
BaS+2CO2↑;煤粉燃烧放出大量的热,且C与BaSO4反应生成BaS的反应中C为还原剂,可见煤粉的主要作用是燃烧供热和作还原剂;
(2)若回转窑中通过量空气,S元素会部分被氧化,导致BaS的量减少,则由BaS制取得到的BaCO3就会减少,因此最终使BaCO3产率降低;
(3)用 90~95℃的热水浸取BaS转化为可溶性化合物时,此时无气体生成,此过程反应的化学方程式为:2BaS+2H2O![]() Ba(HS)2+Ba(OH)2;
Ba(HS)2+Ba(OH)2;
(4)在回转窑产生的废气中含有CO、CO2,其中CO2在碳化过程与Ba(HS)2、Ba(OH)2发生反应:Ba2++2HS-+CO2+H2O=BaCO3↓+2H2S↑、CO2+Ba(OH)2=BaCO3↓+H2O,得到重新利用,可用于制取BaCO3;硫化钡黑灰热水浸取,保温后热过滤除去的残渣中含有未反应的C单质及CaSO4,也可在其他工业生产中再利用,如废渣中的 CaSO4可作建筑材料,也可以用于制取石膏;
(5)从反应后的溶液中过滤可得到BaCO3,为了得到纯净的BaCO3,要除去固体表面的杂质离子,所以省略的操作是过滤、洗涤、干燥;
(6)已知反应BaSO4(s)+CO32-(aq)![]() BaCO3(s)+SO42-(aq),假设每次能处理BaSO4的物质的量为x,根据方程式可知反应产生SO42-物质的量为x,反应消耗CO32-后剩余离子物质的量为(2-x)mol,K=
BaCO3(s)+SO42-(aq),假设每次能处理BaSO4的物质的量为x,根据方程式可知反应产生SO42-物质的量为x,反应消耗CO32-后剩余离子物质的量为(2-x)mol,K=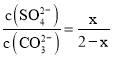 =
=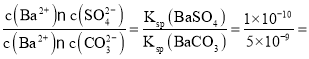 0.02,解得x=0.039 mol,所以需要处理的次数为:
0.02,解得x=0.039 mol,所以需要处理的次数为:![]() =7.69,故至少要处理8次。
=7.69,故至少要处理8次。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案【题目】下列实验操作、现象和所得结论都正确的是
选项 | 实验 | 现象 | 结论 |
A | 向滴有酚酞的 Na2CO3 溶液中加入少量氯化钡固体,振荡 | 溶液红色变浅 | Na2CO3溶液存在水解平衡 |
B | 向X溶液中滴加几滴新制氯水,振 荡 ,再加入少量KSCN溶液 | 溶液变为红色 | X溶液中一定含有Fe2+ |
C | 检验食盐是否加碘( KIO3), 取少量食盐溶于水,用淀粉碘化钾试纸检验 | 试纸不变蓝 | 该食盐不含有KIO3 |
D | 向蛋白质溶液中加入CuSO4或( NH4)2 SO4 的饱和溶液 | 均有沉淀生成 | 蛋白质均发生了盐析 |
A.AB.BC.CD.D