题目内容
【题目】氮、磷、砷、铁等元素及其化合物在现代农业、科技、国防建设中有着许多独特的用途。
(1)基态砷原子中核外电子占据最高能层的符号为_______,该能层的原子轨道数有_____ 个。下列有关表示基态氮原子的电子排布图中,仅违背洪特规则的是________(填字母)。
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
(2)氮的一种氢化物 N2H4 是一种良好的火箭发射燃料,传统制备肼的方法是:NaClO+2NH3=N2H4+NaCl+H2O,又知肼的熔点、沸点分别为1.4 ℃、113.5 ℃,氨气的熔点、沸点分别为-77.7 ℃、-33.5 ℃。
①N2H4中氮原子的杂化轨道类型为_______杂化。
②H2O的VSEPR模型为______。
③肼与氨气熔点、沸点差异最主要的原因是_________________。
(3)氨分子是一种常见配体,配离子[Co(NH3)6]3+中存在的化学键有___________ (填序号)。
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
(4)已知[Co(NH3)6]3+的几何构型为正八面体形,推测[CoCl3(NH3)3]结构有__________种。
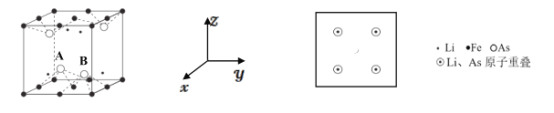
(5)LiFeAs可组成一种新型材料,其立方晶胞结构如图所示。若晶胞参数为 a nm,A、B 处的两个As原子之间距离=______nm,请在z轴方向投影图中画出铁原子的位置,用“ ”表示__________。
【答案】N 16 B sp3 四面体形 N2H4分子间氢键数目多于NH3分子间氢键数目 BC 2 ![]()

【解析】
(1)As原子序数是33,位于元素周期表第四周期第VA,根据能层序号判断;结合每个能层具有的能级种类及各种能级具有的轨道数目确定;根据原子核外电子排布遵循的规律分析判断;
(2)根据价层电子对互斥理论判断N2H4的杂化轨道类型及H2O的VSEPR模型;结合分子之间的分子间作用力和氢键的数目分析;
(3)配体与中心离子之间存在配位键,配体分子中存在共价键;据此分析;
(4)[Co(NH3)6]3+的几何构型为正八面体形,Co3+位于正八面体几何中心,6个NH3分别位于正八面体形的6个顶点上,其中3个NH3换为Cl-就得到[CoCl3(NH3)3];
(5)根据LiFeAs晶胞中各个原子的相对位置分析解答。
(1)As原子序数是33,位于元素周期表第四周期第VA,原子核外具有四个能层,核外电子排布时按能层能量由低到高顺序排列依次是K、L、M、N、O、P、Q,所以基态砷原子中核外电子占据最高能层的符号为N;第四能层含有4s、4p、4d、4f四种能级,各种能级分别含有的轨道数目为1、3、5、7,所以该能层的原子轨道数有1+3+5+7=16个;
A.2s轨道的能量比2p轨道的能量低,![]() 违背能量最低原理,A不符合题意;
违背能量最低原理,A不符合题意;
B.电子在同一能级不同的原子轨道上排布时,电子总是尽可能分占不同的原子轨道且自旋方向相同,![]() 违背洪特规则,B符合题意;
违背洪特规则,B符合题意;
C. ![]() 遵循核外电子排布规律,C不符合题意;
遵循核外电子排布规律,C不符合题意;
D.同一轨道上不可能存在自旋方向相同的电子,![]() 违背泡利原理,D不符合题意;
违背泡利原理,D不符合题意;
故答案选B;
(2)①在N2H4中N原子形成3个σ键且N原子上还有1对孤电子对,价层电子对数是4,所以N原子杂化轨道类型是sp3杂化;
②H2O中O原子价层电子对数为2+![]() =4,所以其VSEPR模型为四面体形;
=4,所以其VSEPR模型为四面体形;
③N2H4、NH3都是由分子构成的分子晶体,在分子之间都存在分子间作用力,由于都含有N—H键,N元素的非金属性强、原子半径小,所以二者的分子之间还都存在氢键,增加了分子间作用力,但由于N2H4分子间氢键数目多于NH3分子间氢键数目,所以克服氢键和分子间作用力使物质熔化、气化需要较高的能量,因此肼的熔点、沸点比氨气高;
(3)氨分子是一种常见配体,配离子[Co(NH3)6]3+中NH3与Co3+之间存在配位键;在NH3中N、H原子之间存在极性共价键N-H键,所以[Co(NH3)6]3+中的化学键有配位键、极性共价键,答案选BC;
(4)[Co(NH3)6]3+为正八面体,Co3+位于正八面体几何中心,其中一个NH3分子换成Cl-后结构中有2种位置不同NH3,所以若将[Co(NH3)6]3+中的3个NH3换成Cl-,就得到2种不同结构的[CoCl3(NH3)3];
(5)根据晶胞示意图可知晶胞中含有4个As原子,4个As原子构成一个正四面体,A、B两个As原子之间距离为面对角线长度的一半,由于晶胞参数为 a nm,则面对角线长度为![]() a nm,所以A、B两个As原子之间距离=
a nm,所以A、B两个As原子之间距离=![]() nm;在该晶体中Li、As原子在span>z轴方向投影重叠,Fe原子位于晶胞的8个顶点、8个棱心和2个面心,Fe原子在z轴方向投影位于顶点上、棱中心和面心上,投影示意图为
nm;在该晶体中Li、As原子在span>z轴方向投影重叠,Fe原子位于晶胞的8个顶点、8个棱心和2个面心,Fe原子在z轴方向投影位于顶点上、棱中心和面心上,投影示意图为 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案