题目内容
【题目】下列反应的离子方程式书写正确的是( )
A.Fe溶于足量稀HNO3:3Fe+8H++2![]() =3Fe2++2NO↑+4H2O
=3Fe2++2NO↑+4H2O
B.NaHCO3溶液与NaOH溶液反应:![]() +OH-=CO2↑+H2O
+OH-=CO2↑+H2O
C.向NaAlO2溶液中加入过量的稀HCl:![]() +H++H2O=Al(OH)3↓
+H++H2O=Al(OH)3↓
D.氨水和醋酸溶液混合:NH3H2O+CH3COOH=NH4++CH3COO-+H2O
【答案】D
【解析】
A.二者反应生成硝酸铁、NO和水,正确的离子方程式为:Fe+4H++NO3-=Fe3++NO↑+2H2O,故A错误;
B.NaHCO3溶液与NaOH溶液反应生成Na2CO3和H2O,离子反应为:OH-+HCO3-=CO32-+H2O,故B错误;
C.向NaAlO2溶液中加入过量的稀HCl最终生成铝离子,正确的离子方程式为:AlO2-+4H+=Al3++2H2O,故C错误;
D.氨水和醋酸溶液混合的离子反应为NH3H2O+CH3COOH=NH4++CH3COO-+H2O,故D正确。
答案选D。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】Ⅰ、某化学研究性学习小组为探究元素性质的变化规律,设计了如下实验:
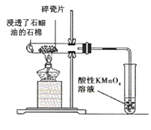
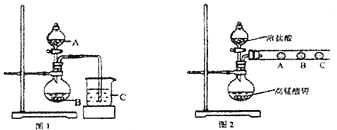
(1)甲同学欲比较N、C、Si的非金属性强弱,设计了图1所示的实验装置,其设计的依据是 ;但该装置存在缺陷,请指出 。
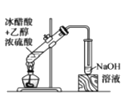
(2)乙同学设计了如图2装置验证元素性质递变规律。A、B、C处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸。乙同学可能观察到的现象
A. ;B. ;C. 。
从环保角度考虑,该装置有明显不足,请指出提出改进建议 。
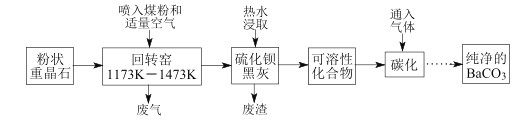
Ⅱ、另一化学研究性学习小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。
步骤一:电解精制:电解时,粗铜应与电源的 极相连。阴极上的电极反应式为 。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

(1)阳极泥的综合利用:稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该步反应的离子方程式: 。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的信息:
序号 | 反应 | 平衡常数 |
1 |
|
|
2 |
|
|
请根据以上信息简要解释溶解阳极泥不用王水的原因 。
(2)滤液含量的测定:以下是该小组探究滤液的一个实验流程。
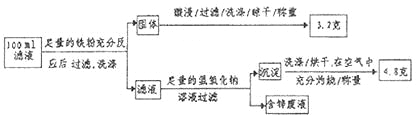
则![]() 滤液中
滤液中![]() 的浓度为
的浓度为 ![]() ,
,![]() 的浓度为
的浓度为 ![]() 。
。