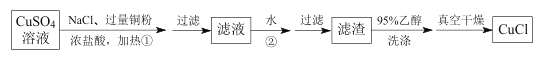
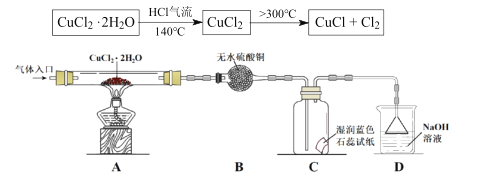
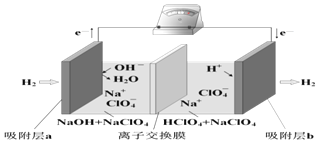
��Ŀ����
����Ŀ��������������������������ѳ�Ϊ������ѧ����Ҫ���⡣
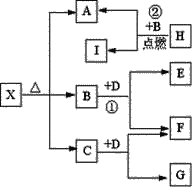
(1)�ڽ���Pt��Cu��ҿ(Ir)�Ĵ������£��ܱ������е�H2�ɸ�Чת��������Һ�е���̬��(NO3-)���乤��ԭ����ͼ��ʾ��
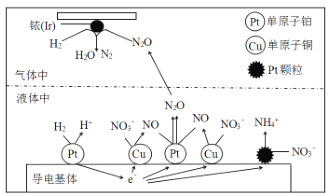
����ҿ(Ir)���淢����������ԭ��Ӧ���仹ԭ����ĵ���ʽ��_____������������ϵ�Pt�������࣬�����ڽ�����Һ�ĺ��������õ缫��Ӧʽ����ԭ�� _____________��
(2)���ܱ������г��� 10 mol CO��8 mol NO��������Ӧ 2NO(g)+2CO(g)![]() N2(g) +2CO2(g) H<0����ͼΪƽ��ʱNO������������¶ȡ�ѹǿ�Ĺ�ϵ��
N2(g) +2CO2(g) H<0����ͼΪƽ��ʱNO������������¶ȡ�ѹǿ�Ĺ�ϵ��
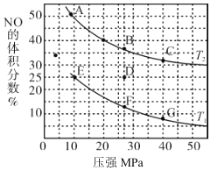
�ٸ÷�Ӧ�ﵽƽ���Ϊ��߷�Ӧ������ͬʱ���ת���ʣ��ɲ�ȡ�Ĵ�ʩ��_______(����ţ���
a�����ø�Ч���� b����С���������
c�������¶� d����СCO2��Ũ��
��ѹǿΪ20 MPa���¶�ΪT2�£�����Ӧ�ﵽƽ��״̬ʱ���������Ϊ4 L�����ʱCO2��Ũ��Ϊ_______��
������D��Է�Ӧ�������µ�ͬʱ�������������ϵѹǿ��С�����´ﵽ��ƽ��״̬������ͼ��A ~G���е�_______�㡣
(3)�о�������NOx���ѳ��ʳ��뻹ԭ������������⣬�������������ȱλ���ܼ��̶ȳ����ȡ���La0.8A0.2BCoO3+x(A��B��Ϊ����Ԫ��)Ϊ��������H2��ԭNO�Ļ������£�
��һ�Σ�B4+(���ȶ�)+H2���ͼ�̬�Ľ�������(��ԭǰ������н���ԭ�ӵĸ�������)
�ڶ��Σ�NO(g)+����NO(a) ��H1 K1 2NO(a)��2N(a)+O2(g) ��H2 K2
2N(a)��N2(g)+2�� ��H3 K3 2NO(a)��N2(g)+2O(a) ��H4 K4
2O(a)��O2(g)+2�� ��H5 K5
ע����������ʾ�����������ȱλ����g����ʾ��̬����a����ʾ����̬��
��һ����������ԭB4+�õ��ͼ�̬�Ľ�������Խ�࣬�ڶ��η�Ӧ������Խ�죬ԭ����________________���ڶ����и���Ӧ�ʱ��Ĺ�ϵ��H2+H3=_____�����¶��£�NO�ѳ���Ӧ2NO(g)![]() N2(g)+O2(g)��ƽ�ⳣ��K=____ (�ú�K1��K2��K3�ı���ʽ��ʾ����
N2(g)+O2(g)��ƽ�ⳣ��K=____ (�ú�K1��K2��K3�ı���ʽ��ʾ����
���𰸡�![]() NO3-+8e-+10H+=NH4++3H2O b 0.25 mol/L A ��ԭ������н���ԭ�ӵĸ������䣬��̬���ͣ���ȱλ���࣬��Ӧ���ʼӿ� ��H4+��H5
NO3-+8e-+10H+=NH4++3H2O b 0.25 mol/L A ��ԭ������н���ԭ�ӵĸ������䣬��̬���ͣ���ȱλ���࣬��Ӧ���ʼӿ� ��H4+��H5 ![]() ��K2��K3
��K2��K3
��������
(1)�ڴ�������H2��N2O��Ӧ����N2��H2O��NԪ�ػ��ϼ۽��ͣ��õ����ӱ���ԭ��N2��2��Nԭ��ͨ�����Թ��õ��ӶԽ�ϣ�Pt����������NO3-�õ����ӷ�Ӧ����NH4+��
(2)�ٷ�Ӧ2NO(g)+2CO(g)![]() N2(g)+2CO2(g) H<0������Ӧ�����������С�ķ��ȷ�Ӧ��������������Ի�ѧ��Ӧ���ʺͻ�ѧƽ���ƶ���Ӱ������жϣ�
N2(g)+2CO2(g) H<0������Ӧ�����������С�ķ��ȷ�Ӧ��������������Ի�ѧ��Ӧ���ʺͻ�ѧƽ���ƶ���Ӱ������жϣ�
�ڼ��跴Ӧ������N2�����ʵ���Ϊx����������ת����ϵ����Ӧ��ʼʱCO��NO�����ʵ���������ƽ��ʱNO���������Ϊ40%�����������ƽ�����ʵ������ٸ���c=![]() ����CO2��ƽ��Ũ�ȣ�
����CO2��ƽ��Ũ�ȣ�
�۸����¶ȡ�ѹǿ��ƽ���ƶ���Ӱ�����NO�ĺ��������жϣ�
(3)��ԭ������н���ԭ�ӵĸ������䣬��̬���ͣ���ȱλ���࣬��Ӧ���ʼӿ죻���ݸ�˹���ɺͻ�ѧƽ�ⳣ���Ķ�������ɵá�
(1)�ڴ������淢��������ԭ��ӦH2+N2O=N2+H2O��N2O����ԭ����N2��Nԭ���������5�����ӣ���N2��2��Nԭ���γ����Թ��õ��Ӷԣ�ʹ������ÿ��ԭ�Ӷ��ﵽ�����8�����ӵ��ȶ��ṹ������ʽΪ��![]() ������������ϵ�Pt�������࣬���в���NO3-�õ���������Һ�е�H+����γ�NH4+���缫��ӦʽΪ��NO3-+8e-+10H+=NH4++3H2O����Ӧ������NH4+��Ȼ��������Һ�У���˲����ڽ�����Һ�ĺ�������
������������ϵ�Pt�������࣬���в���NO3-�õ���������Һ�е�H+����γ�NH4+���缫��ӦʽΪ��NO3-+8e-+10H+=NH4++3H2O����Ӧ������NH4+��Ȼ��������Һ�У���˲����ڽ�����Һ�ĺ�������
(2)��a�����ø�Ч����ֻ�ܼӿ췴Ӧ���ʵ�����ʹ��ѧƽ�ⷢ���ƶ�����˲�����߷�Ӧ���ת���ʣ�a���������⣻
b����С�����������ʹ��ϵ��ѹǿ����Ӧ��������ѧƽ�������������С������Ӧ�����ƶ�����Ӧ���ת������ߣ�b�������⣻
c�������¶Ȼ�ѧ��Ӧ���ʼӿ죬�����ڸ÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ���ѧƽ�������ȵ��淴Ӧ�����ƶ�����Ӧ���ת���ʼ�С��c���������⣻
d����С������CO2��Ũ�ȣ���ѧƽ�������ƶ�����Ӧ��ת������ߣ���������Ũ�Ƚ��ͣ���ʹ��Ӧ���ʽ��ͣ�d���������⣻
�ʴ�ѡb��
����Ӧ�����м���10 mol CO��8 mol NO ��������Ӧ��2NO(g)+2CO(g)![]() N2(g)+2CO2(g)�����跴Ӧ����N2�����ʵ���Ϊx����CO2Ϊ2x mol������NO��CO���ʵ�������2x mol������ƽ��ʱn(CO)=(10-2x) mol��n(NO)=(8-2x) mol��n(CO2)=2x mol��n(N2)=x mol������ͼ���֪��Ӧ��ѹǿΪ20 MPa���¶�ΪT2�´ﵽƽ��ʱ��NO�����������40%������
N2(g)+2CO2(g)�����跴Ӧ����N2�����ʵ���Ϊx����CO2Ϊ2x mol������NO��CO���ʵ�������2x mol������ƽ��ʱn(CO)=(10-2x) mol��n(NO)=(8-2x) mol��n(CO2)=2x mol��n(N2)=x mol������ͼ���֪��Ӧ��ѹǿΪ20 MPa���¶�ΪT2�´ﵽƽ��ʱ��NO�����������40%������![]() =40%�����x=0.5 mol����ƽ��ʱCO2�����ʵ���Ϊ2x=2��0.5 mol=1 mol�����ڴ�ʱ�������ݻ�Ϊ4 L������CO2��ƽ��Ũ��c(CO2)=
=40%�����x=0.5 mol����ƽ��ʱCO2�����ʵ���Ϊ2x=2��0.5 mol=1 mol�����ڴ�ʱ�������ݻ�Ϊ4 L������CO2��ƽ��Ũ��c(CO2)=![]() =0.25 mol/L��
=0.25 mol/L��
�۷�Ӧ2NO(g)+2CO(g)![]() N2(g)+2CO2(g) H<0������Ӧ�����������С�ķ��ȷ�Ӧ����ѹǿ����ʱ�������¶ȣ�ƽ�������ƶ���NO������������������¶�T2>T1����D��Ļ������ȣ�ƽ�������ƶ�NO����������������¶Ȳ���ʱ���������������ϵѹǿ��С����ѧƽ�����������������淴Ӧ�����ƶ���ʹNO����������������´ﵽ��ƽ��״̬������ͼ��A ~G���е�A�㣻
N2(g)+2CO2(g) H<0������Ӧ�����������С�ķ��ȷ�Ӧ����ѹǿ����ʱ�������¶ȣ�ƽ�������ƶ���NO������������������¶�T2>T1����D��Ļ������ȣ�ƽ�������ƶ�NO����������������¶Ȳ���ʱ���������������ϵѹǿ��С����ѧƽ�����������������淴Ӧ�����ƶ���ʹNO����������������´ﵽ��ƽ��״̬������ͼ��A ~G���е�A�㣻
(3)��һ����������ԭB4+�õ��ͼ�̬�Ľ�������Խ�࣬��ԭ������н���ԭ�ӵĸ������䣬��̬���ͣ���ȱλ���࣬��Ӧ���ʼӿ죬�ʵڶ��η�Ӧ������Խ�죻
��֪����NO(g)+����NO(a) ��Hspan>1 K1
��2NO(a)��2N(a)+O2(g) ��H2 K2
��2N(a)��N2(g)+2�� ��H3 K3
��2NO(a)��N2(g)+2O(a) ��H4 K4
��2O(a)��O2(g)+2�� ��H5 K5
���ݸ�˹���ɣ���+�ۣ������ɵã�2NO(a)=O2(g)+N2(g)+2�� ��H=��H2+��H3��
���ݸ�˹���ɣ���+�ݣ������ɵã�2NO(a)=O2(g)+N2(g)+2�� ��H=��H4+��H5�����Կɵ���H2+��H3=��H4+��H5��
ͬ�����ݸ�˹���ɣ�2����+��+�ۿɵ÷�Ӧ���¶��£�NO�ѳ���Ӧ2NO(g)![]() N2(g)+O2(g)���ʸ÷�Ӧ��ƽ�ⳣ��K=
N2(g)+O2(g)���ʸ÷�Ӧ��ƽ�ⳣ��K=![]() ��K2��K3��
��K2��K3��