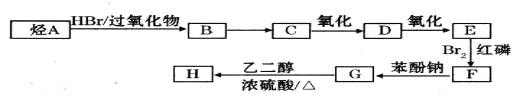
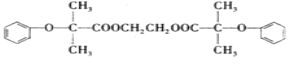题目内容
【题目】一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入350mL 2molL﹣1的稀硝酸恰好使混合物完全溶解,放出2.24L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为( )
A. 0.21 molB. 0.25 molC. 0.3 molD. 0.35 mol
【答案】C
【解析】
因一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入350mL 2mol/L的稀硝酸,恰好使混合物完全溶解,无血红色出现,说明溶液中的溶质为Fe(NO3)2,根据氮元素守恒,硝酸亚铁中的硝酸根离子的物质的量为0.35L×2mol/L-![]() =0.6mol,所以n[Fe(NO3)2]=
=0.6mol,所以n[Fe(NO3)2]=![]() =0.3mol,由铁元素守恒可知,氢气还原混合物得到Fe的物质的量:n(Fe)=n[Fe(NO3)2]=0.3mol,故答案为C。
=0.3mol,由铁元素守恒可知,氢气还原混合物得到Fe的物质的量:n(Fe)=n[Fe(NO3)2]=0.3mol,故答案为C。

练习册系列答案
相关题目
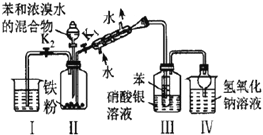
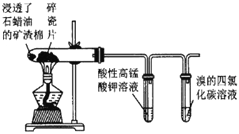
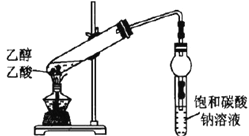
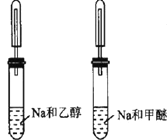
【题目】下列实验所用试剂、现象和结论均正确的是
选项 | 实验装置 | 现象 | 结论 |
A |
| 装置Ⅲ中有浅黄色沉淀 | 苯和浓溴水发生取代反应 |
B |
| 高锰酸钾溶液褪色,溴的四氯化碳溶液褪色 | 石蜡油的分解产物中含有不饱和烃 |
C |
| 盛有饱和碳酸钠溶液的试管中,上方出现油状液体 | 制备乙酸乙酯 |
D |
| 甲醚有气泡 | 鉴别乙醇与甲醚(CH3OCH3) |
A. A B. B C. C D. D