【题目】下列变化中,气体反应物既被氧化又被还原的是
A.金属钠露置在空气中迅速变暗
B.露置在空气中的过氧化钠固体变白
C.将氨气与氯化氢混合,产生大量白烟
D.充满二氧化氮的试管倒扣在水槽中,试管内液面上升
【题目】某温度时,在2 L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析可得:

(1)该反应的化学方程式为___________________________。
(2)反应开始至2 min,用Y表示的平均反应速率为_________,X的转化率为________。
(3)在一定温度下,下列情况可作为上述反应达到反应限度的标志的是_______。
A.X、Y、Z的浓度相等 |
B.X、Y、Z的分子数比为3︰1︰2 |
C.Z的生成速率是Y的生成速率的二倍 |
D.单位时间内生成n mol Y,同时生成3n mol X |
(4)在密闭容器里,通入a mol A(g)和b mol B(g),
发生反应A(g)+ B(g)= 2C(g),当改变下列条件时,会加快反应速率的是________(填序号)。
①降低温度
②保持容器的体积不变,充入氦气
③加入催化剂
④保持容器的体积不变,增加A(g)的物质的量
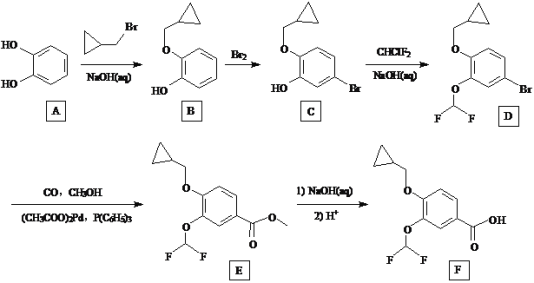
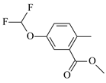
【题目】H2O2的制取及其在污水处理方面的应用是当前科学研究的热点。 回答下列问题:
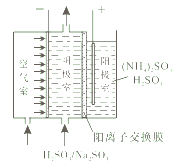
(1)阴阳极同步产生过氧化氢和过硫酸铵[(NH4)2S2O8]的原理如图所示。阳极发生氧化反应的离子是_______,阴极的电极反应式为_________。
(2)100℃时,在不同金属离子存在下,纯过氧化氢24h的分解率见下表:
离子 | 加入量/(mg·L-1) | 分解率/% | 离子 | 加入量/(mg·L-1) | 分解率/% | |
无 | — | 2 | Fe3+ | 1.0 | 15 | |
Al3+ | 10 | 2 | Cu2+ | 0.1 | 86 | |
Zn2+ | 10 | 10 | Cr3+ | 0.1 | 96 |
由上表数据可知,能使过氧化氢分解反应活化能降低最多的离子是_______。贮运过氧化氢时,可选用的容器材质为________(填标号)。
A 纯铝 B 黄铜 C 铸铁 D 不锈钢
(3)在弱碱性条件下,H2O2的一种催化分解机理如下:
H2O2(aq)+Mn2+(aq)=OH(aq)+Mn3+(aq)+OH-(aq) ΔH=a kJ/mol
H2O2(aq)+Mn3+(aq)+2OH-(aq)=Mn2+(aq)+·O2- (aq)+2H2O(l) Δ=b kJ/mol
OH(aq)+·O2-(aq)=O2(g)+OH-(aq) ΔH=c kJ/mol
则2H2O2(aq)=2H2O(l)+O2(g)的ΔH=_________,该反应的催化剂为________。
(4)298 K时,将10 mL a mol·L1 NaH2PO2、10 mL 2a mol·L1 H2O2溶液和10 mL NaOH溶液混合,发生反应:H2PO2-(aq)+2H2O2(aq)+2OH(aq)![]() PO43-(aq)+4H2O(l)。溶液中c(PO43-)与反应时间(t)的关系如图所示。
PO43-(aq)+4H2O(l)。溶液中c(PO43-)与反应时间(t)的关系如图所示。
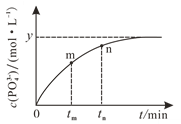
①下列可判断反应达到平衡的是_______(填标号)。
a c(H2PO2-)=y mol·L1
b 溶液的pH不再变化
c v(H2O2)=2v(H2PO2-)
d c(PO43-)/c(H2PO2-)不再变化
②tm时v逆_____tn时v逆(填“大于”“小于”或“等于”)。
③若平衡时溶液的pH=12,则该反应的平衡常数K为___________。