��Ŀ����
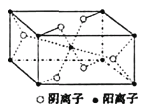
����Ŀ��ij�¶�ʱ����2 L�ܱ������У�������̬����X��Y��Z�����ʵ�����n����ʱ�䣨t���仯��������ͼ��ʾ����ͼ�����ݷ����ɵã�

��1���÷�Ӧ�Ļ�ѧ����ʽΪ___________________________��
��2����Ӧ��ʼ��2 min����Y��ʾ��ƽ����Ӧ����Ϊ_________��X��ת����Ϊ________��
��3����һ���¶��£������������Ϊ������Ӧ�ﵽ��Ӧ�ȵı�־����_______��
A��X��Y��Z��Ũ����� |
B��X��Y��Z�ķ�������Ϊ3�U1�U2 |
C��Z������������Y���������ʵĶ��� |
D����λʱ��������n mol Y��ͬʱ����3n mol X |
��4�����ܱ������ͨ��a mol A��g����b mol B��g����
������ӦA��g��+ B��g��= 2C��g�������ı���������ʱ����ӿ췴Ӧ���ʵ���________������ţ���
�ٽ����¶�
�ڱ���������������䣬���뺤��
�ۼ������
�ܱ���������������䣬����A��g�������ʵ���
���𰸡�3X+Y![]() 2Z 0.025mol/(L��min) 30% C �ۢ�
2Z 0.025mol/(L��min) 30% C �ۢ�
��������
��1��X��Y���ʵ�����С������Ӧ�Z���ʵ����������������ѧ��Ӧ����֮��=��ѧ������֮�ȣ���Ϊ��ʱ��������������ʵ���֮�ȵ��ڻ�ѧ������֮�ȣ�X��Y��Z=(1��0.7)��(1��0.9)��0.2=3��1��2�� 3X+Y![]() 2Z��
2Z��
��2�����ݻ�ѧ��Ӧ���ʵ���ѧ����ʽ��v(Y)=(1��0.9)/(2��2)mol/(L��min)="0.025" mol/(L��min)��X��ת����=(1��0.7)/1��100%=30%��
��3��A�����ݻ�ѧƽ��״̬���壬����ֵ�Ũ�Ȳ��ٸı䣬˵���ﵽƽ�⣬�ʴ���B��û��ָ����Ӧ�������жϵ�ƽ�⣬�ʴ���C����ͬ���ʵķ�Ӧ�����жϴﵽƽ�⣬Ҫ��һ��һ�棬�ҷ�Ӧ����֮�ȵ���ϵ��֮�ȣ�����ȷ��D����Ӧ�������淴Ӧ���ʴ���
��4���ٽ����¶ȣ���ѧ��Ӧ���ʼ������ʴ��ں��ݣ�����Ƿ�Ӧ���壬����ֵ�Ũ�Ȳ��䣬��ѧ��Ӧ���ʲ��䣬�ʴ��ۼ���������ӿ췴Ӧ���ʣ�����ȷ��������A�����ʵ���������Ӧ���Ũ�ȣ��ӿ췴Ӧ���ʣ�����ȷ��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��[��ѧ����ѡ��3�����ʽṹ������]
��1���������ƳɵĽ���ȼ�ϡ��ǽ�������ȼ�ϡ���������Ӧ�õ��������߿Ƽ�����λ������A��B����ȼ��ʱ���ų������ȣ�������ȼ�ϡ���֪A��BΪ������Ԫ�أ���ԭ�ӵĵ�һ�����ĵ��������±���ʾ��
�����ܣ�KJ/mol�� | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15399 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
��ijͬѧ����������Ϣ���ƶ�B�ĺ�������Ų�����ͼ��ʾ����ͬѧ�����ĵ����Ų�ͼΥ�� ��BԪ��λ�����ڱ���������е� ����
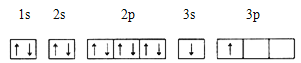
��ACl2������A���ӻ�����Ϊ ��ACl2�Ŀռ乹��Ϊ ��
��2��Feԭ�ӻ�������Χ�н϶���������Ŀչ������һЩ���ӻ������γ�����
�������������ѻ��γɵĽ������У���ԭ�ӵ���λ��Ϊ ��
��д��һ����CN-��Ϊ�ȵ�����ĵ��ʵĵ���ʽ ��
���������������[Fe(CN)6]4-����� ��
A�����ۼ�
B���Ǽ��Լ�
C�����
D������
E������
��3��һ��Al��Fe�Ͻ�����徧������ͼ��ʾ����ݴ˻ش��������⣺
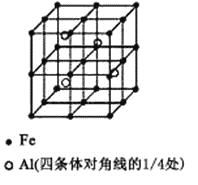
��ȷ���úϽ�Ļ�ѧʽ ��
����������ܶȣ��� g/cm3����˺Ͻ������������Feԭ��֮��ľ���(�ú����Ĵ���ʽ��ʾ�����ػ���)Ϊ cm��