题目内容
【题目】A、B、C、D、E、F六种元素的原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍。请回答下列问题:
(1)F的基态原子价电子排布式为____________________ 。
(2)B、C、D、E的原子的第一电离能由小到大的顺序为_______________(用元素符号回答)
(3)下列关于B2A2分子和A2D2分子的说法正确的是______________
A 分子中都含有σ键和π键
B 中心原子都sp杂化
C 都是含极性键和非极性键的非极性分子
D 互为等电子体
E.B2A2分子的沸点明显低于A2D2分子
(4)F2+能与BD分子形成[F(BD)4]2+,其原因是BD分子中含有_________
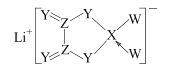
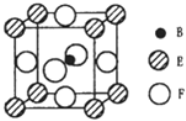
(5)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如图所示.B位于E和F原子紧密堆积所形成的空隙当中.与一个F原子距离最近的F原子的数目为_________,该晶体的化学式为_______.若该晶体的相对分子质量为M,阿伏加德罗常数为NA,B、E、F三种元素的原子半径分别为r1pm、r2pm、r3pm,则该晶体的密度表达式为____________________。
【答案】(每空2分)
(1)3d84s2
(2)Mg<C<O<N
(3)E
(4)孤电子对
(5)8 MgNi3C 1030M/2![]() (r2+r3)NAg/cm3。
(r2+r3)NAg/cm3。
【解析】
试题B的基态原子有3个不同的能级且各能级中电子数相等,说明B的基态原子的3个能级分别是1s、2s、2p,均有3个电子,所以B是C元素;A的原子序数小于B,最高正价和最低负价的绝对值相等,所以A是H元素;D的基态原子与B的基态原子的未成对电子数目相同,B中有2个未成对电子,D的原子序数大于B,则D的核外电子排布为1s22s22p4,所以D是O元素;所以C是N元素;E的基态原子的电子总数与p能级的电子数相等,E的原子序数大于D,则E的核外电子排布为1s22s22p63s2,所以E是Mg元素;F的基态原子的3d轨道电子数是4s电子数的4倍,则3d轨道有8个电子,所以F是Ni元素。根据以上
(1)F的基态原子价电子排布式为3d84s2
(2)C、N、O、Mg四种元素中,Mg的金属性最强,所以第一电离能最小,C、N、O中,N的3p轨道式半充满状态,是稳定状态,所以第一电离能较大,同周期元素中随核电荷数的增大,第一电离能增大,所以第一电离能的顺序是Mg<C<O<N;
(3)C2H2和H2O2中,A、前者都含有σ键和π键,后者只含σ键,错误;B、前者C原子是sp杂化,后者不是,错误;C、前者是直线型分子,是含极性键和非极性键的非极性分子,后者是V型分子,不是非极性分子,错误;D、二者的价电子的总数不同,不是等电子体,错误;E、二者都是分子晶体,后者的相等分子质量大,且前者常温下是气体,后者是液体,后者沸点高,正确,答案选E;
(4)F2+能与BD分子形成[F(BD)4]2+,其原因是BD分子中含有孤对电子,F2+有空轨道,可以形成配位键;
(5)F位于正方体的面的中心,所以与一个F原子距离最近的F原子的数目为8个,上下各4个;该晶胞中F的个数是6×1/2=3,E位于正方体的8个顶点,所以E得个数是8×1/8=1,B位于体内,个数是1,所以该晶体的化学式为MgNi3C;晶胞的质量是M/NAg,E、F两个原子的直径是晶胞底面的对角线,设晶胞的棱长为acm,则![]() a=2(r2+r3)pm=(2r2+2r3)×10-10cm,所以可求晶胞的密度为M/NA/a3=1030M/2
a=2(r2+r3)pm=(2r2+2r3)×10-10cm,所以可求晶胞的密度为M/NA/a3=1030M/2![]() (r2+r3)NAg/cm3。
(r2+r3)NAg/cm3。