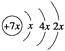题目内容
【题目】(13分)X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子。请回答下列问题:
(1)Y基态原子的电子排布式是________;Z所在周期中第一电离能最大的主族元素是_____。
(2)XY2-离子的立体构型是_______;R2+的水合离子中,提供孤电子对的是原子是______。
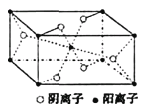
(3)Z与某元素形成的化合物的晶胞如右图所示,晶胞中阴离子与阳离子的个数之比是___________。
(4)将R单质的粉末加入XH3的浓溶液中,通入Y2,充分反应后溶液呈深蓝色,该反应的离子方程式是____________。
【答案】(1)1s22s22p4;Cl (2)V形;O (3)2:1
(4)2Cu+8NH3·H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O
【解析】
试题X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体,该气体是NO2,则X是氮元素,Y是氧元素;X与氢元素可形成XH3,该气体是氨气;Z基态原子的M层与K层电子数相等,则该元素的原子序数是2+8+2=12,即为镁元素;R2+离子的3d轨道中有9个电子,因此R的原子序数是18+9+2=29,即为铜元素。
(1)氧元素的原子序数是8,则根据核外电子排布规律可知,氧元素基态原子的电子排布式是1s22s22p4;同周期自左向右元素的第一电离能逐渐增大,镁是第三周期,则所在周期中第一电离能最大的主族元素是Cl元素。
(2)根据价层电子对互斥理论可知,NO2-离子中心原子氮原子含有的孤对电子对数=![]() =1,即氮原子的价层电子对数是3,由于含有一对孤对电子,因此其离子的立体构型是V形;铜离子含有空轨道,而水分子中的氧原子含有孤对电子,因此在Cu2+的水合离子中,提供孤电子对的是原子是O原子。
=1,即氮原子的价层电子对数是3,由于含有一对孤对电子,因此其离子的立体构型是V形;铜离子含有空轨道,而水分子中的氧原子含有孤对电子,因此在Cu2+的水合离子中,提供孤电子对的是原子是O原子。
(3)根据晶胞结构可知,阳离子在8个顶点和体心处各一个,则根据均摊法可知,阳离子个数=1+8×![]() =2个。阴离子在上下面各2个,晶胞内部2个,则阴离子个数=4×
=2个。阴离子在上下面各2个,晶胞内部2个,则阴离子个数=4×![]() +2=4个,因此晶胞中阴离子与阳离子的个数之比是4:2=2:1。
+2=4个,因此晶胞中阴离子与阳离子的个数之比是4:2=2:1。
(4)将R单质的粉末加入氨气的浓溶液中,通入氧气,充分反应后溶液呈深蓝色,这说明在反应中铜被氧化氧化为铜离子与氨气结合形成配位键,则该反应的离子方程式是2Cu+8NH3·H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】某温度时,在2 L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析可得:

(1)该反应的化学方程式为___________________________。
(2)反应开始至2 min,用Y表示的平均反应速率为_________,X的转化率为________。
(3)在一定温度下,下列情况可作为上述反应达到反应限度的标志的是_______。
A.X、Y、Z的浓度相等 |
B.X、Y、Z的分子数比为3︰1︰2 |
C.Z的生成速率是Y的生成速率的二倍 |
D.单位时间内生成n mol Y,同时生成3n mol X |
(4)在密闭容器里,通入a mol A(g)和b mol B(g),
发生反应A(g)+ B(g)= 2C(g),当改变下列条件时,会加快反应速率的是________(填序号)。
①降低温度
②保持容器的体积不变,充入氦气
③加入催化剂
④保持容器的体积不变,增加A(g)的物质的量
【题目】化工原料异丁烯(C4H8)可由异丁烷(C4H10)直接催化脱氢制备:C4H10(g) ![]() C4H8(g) + H2(g)ΔH=+139 kJ/mol
C4H8(g) + H2(g)ΔH=+139 kJ/mol
(1)该反应的化学平衡常数的表达式为_________________。
(2)一定条件下,以异丁烷为原料生产异丁烯。温度、压强改变对异丁烷平衡转化率的
影响如下图所示。
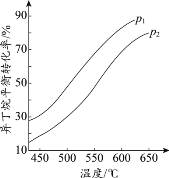
①判断p1、p2的大小关系:p1_________________(填“>”或“<”)p2,理由是_________________。
②若异丁烷的平衡转化率为40%,则平衡混合气中异丁烯的物质的量分数最多为______%(保留小数点后1位)。
(3)目前,异丁烷催化脱氢制备异丁烯的研究热点是催化活性组分以及载体的选择。下表是以V-Fe-K-O为催化活性物质,反应时间相同时,测得的不同温度、不同载体条件下的数据。
温度/℃ | 570 | 580 | 590 | 600 | 610 | |
以γ-Al2O3为载体 | 异丁烷转化率/% | 36.41 | 36.49 | 38.42 | 39.23 | 42.48 |
异丁烯收率/% | 26.17 | 27.11 | 27.51 | 26.56 | 26.22 | |
以TiO2为载体 | 异丁烷转化率/% | 30.23 | 30.87 | 32.23 | 33.63 | 33.92 |
异丁烯收率/% | 25.88 | 27.39 | 28.23 | 28.81 | 29.30 | |
说明:收率=(生产目标产物的原料量/原料的进料量)×100%
①由上表数据,可以得到的结论是____________(填字母序号)。
a.载体会影响催化剂的活性
b. 载体会影响催化剂的选择性
c.载体会影响化学平衡常数
②分析以γ-Al2O3为载体时异丁烯收率随温度变化的可能原因:___________。